Plattform zur Nutzenbewertung – No. 18
AMNOG 2.0 – auf dem Weg zu einem effizienten System? Die Sicht des AOK-BV
Das AMNOG-System hat sich qualitativ bewährt, die Probleme zu hoher Preise für neue Arzneimittel sind aber noch nicht gelöst. Mit dem GKV-FinStG wurden Regelungen ergänzt, die bei vollständiger Umsetzung das Potenzial zur verbesserten Ausgabendämpfung haben könnten. Bislang bleibt der Markteinstieg jedoch zu Unrecht ausgespart: Um international vergleichbare Rahmenbedingungen zu schaffen, sollte ein Interimspreis eingeführt werden, der für ein neues Arzneimittel ab dem ersten Tag gilt und rückwirkend durch den Erstattungsbetrag ersetzt wird. Ergänzend könnte mehr Wirtschaftlichkeit im Patentmarkt durch Etablierung eines wirkstoffübergreifenden Vertragswettbewerbs, aber auch über einen stärker kostenbasierten Ansatz der Erstattungsbetragsverhandlungen erzielt werden. Die Vertraulichkeit des Erstattungsbetrags ist hingegen ein Irrweg zulasten der Solidargemeinschaft.
Veröffentlicht:
© Pixelot / stock.adobe.com
GKV-Finanzstabilisierungsgesetz: Notwendige Stärkung des Interessensausgleichs
Seit der AMNOG-Reform im Jahr 2010 wurden die Regelungen zur frühen Nutzenbewertung im Gemeinsamen Bundesausschuss und den sich daran anschließenden Erstattungsbetragsverhandlungen fast jährlich modifiziert. Als „lernendes System“ angelegt, kam es nicht nur zum Schluss von Lücken, es wurden auch Regelungen immer wieder neu geprägt. Unbestritten hat die Einführung des AMNOG-Systems mehr Transparenz durch die qualitative Bewertung neuer Arzneimittel erbracht und geholfen, dass neue Präparate zielgerichteter bei Patientinnen und Patienten eingesetzt werden können. Bislang ist es jedoch nicht gelungen, die Ausgabendynamik in diesem Marktsegment nachhaltig zu bremsen, wie der Beitrag von Marcel Fritz aufzeigt.

© cacaroot / stock.adobe.com | Springer Medizin Verlag
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Februar 2024 in Heft 18 („AMNOG 2.0: Auf dem Weg zu einem effizienten System“) erschienen.
AMNOG2.0 - Auf dem Weg zu einem effizienten System (4504 kB)
Zuletzt hatte das GKV-FinStG als größeres Reformvorhaben mit zahlreichen Regelungen den Versuch unternommen, dämpfend auf die Arzneimittelpreise vor allem im Patentmarkt einzuwirken. Ein Jahr nach Inkrafttreten des Gesetzes ist jedoch festzustellen, dass Regelungen in der Umsetzung bislang ökonomisch hinter den Erwartungen zurückbleiben. Gleichwohl sind die Einsparungen bereits verplant, denn damit sollten auch die Mehrausgaben gedeckt werden, die mit dem Arzneimittel-Lieferengpassbekämpfungs- und Versorgungsverbesserungsgesetz (ALBVVG) in den generischen Arzneimittelmarkt gehen.
Die Gründe für die unzureichende Wirkung des GKV-FinStG liegen neben einer Überschätzung der ökonomischen Wirkung auch in der fehlenden Stringenz der gesetzlichen Regelungen. Diese setzten viel Vertrauen in partnerschaftliche Vereinbarungen von GKV-Spitzenverband und pharmazeutische Hersteller bzw. deren Verbände – eine Hoffnung, die nicht unerwartet zu optimistisch war. Damit wird bislang nicht nur die Abrechnung des vorgesehenen Kombinationsabschlags ausgebremst, auch beispielsweise bei der Preis-Mengen-Regelung oder bei den sogenannten Leitplanken führten Auslegungsdifferenzen der Vereinbarungspartner zu Schiedsentscheidungen, die nunmehr beklagt werden. Und nicht nur das – inzwischen gibt es von mehreren Unternehmen Verfassungsbeschwerden gegen Regelungen des Gesetzes: Vor allem der Kombinationsabschlag und die geänderten Preisbildungsregelungen zum Erstattungsbetrag werden als systemwidrige Eingriffe in die etablierten Regeln der Arzneimittelerstattung gewertet.1
Sind die gesetzlichen Regelungen auch aus Sicht der Kostenträger schlecht? Nein. Auch wenn die Erwartungen an das Tempo der Umsetzung und den ökonomischen Ertrag höher waren, so schreibt das GKV-FinStG konsequent den Weg des AMNOG fort: Lücken werden weiterhin aufgefüllt – wie beim Kombinationsabschlag, anfallenden Verwürfen, einer zeitnaheren Geltung des Erstattungsbetrags und der früheren Einbeziehung von Arzneimitteln für seltene Erkrankungen.
Vor allem aber wird mit den neuen Leitplanken bei den Erstattungsbetragsverhandlungen der Verhandlungskorridor enger beschrieben. Das war dringend notwendig in einer Situation, in der nur einer der beiden Vertragspartner eine Vereinbarung verweigern kann, der andere jedoch unter Kontrahierungszwang steht. Denn anders als in den meisten europäischen Staaten kann die GKV in Deutschland überhöhte Erstattungsbeträge nicht alleine verhindern. Selbst die ggf. angerufene Schiedsstelle bewegt sich in dem gesetzlich vorgegebenen Verhandlungsrahmen, so dass Entscheidungen vor allem bei breitem Verhandlungskorridor sehr heterogen ausfallen können. Insofern besteht zurzeit die berechtigte Hoffnung der Kostenträger, dass nach weiteren Klarstellungen die erhoffte Begrenzung der Preissteigerungen greift und damit die erwarteten Einsparungen zumindest annähernd realisiert werden können.
Trotz dieser wichtigen und tendenziell richtigen Schritte gibt es noch weiteren Handlungsbedarf: So erschließt es sich nicht, dass regelhaft zu verwerfende Arzneimittelmengen erst ab einer Bagatellgrenze bei der Festlegung des Erstattungsbetrags berücksichtigt werden und überdies diese Anrechnung nicht per Algorithmus, sondern in Abhängigkeit vom Verhandlungsgeschick der jeweiligen Vereinbarungspartner stattfindet. Eine solche Regelung ist weder mit unseren gesellschaftlichen Ansprüchen an Umwelt- und Ressourcenschutz vereinbar noch nachhaltig. Aufwändig produzierte Ware, die anschließend entsorgt wird, muss tatsächlich die besondere Ausnahme darstellen. Hier bedarf es künftig deutlich stärkerer Anreize für passgenaue Packungsgrößen sowie das Austesten einer möglichst langen Haltbarkeit von Stammlösungen und Zubereitungen, indem entsprechende Kosten vollständig den pharmazeutischen Unternehmen angelastet werden, über die nicht verhandelt wird – und das nicht nur im Patentarzneimittelmarkt.
Entsprechendes sollte auch für den Kombinationsabschlag gelten, so dass der Anteil an Kombinationseinsätzen eines neuen Arzneimittels rechnerisch bei der Festlegung des Erstattungsbetrags zu berücksichtigen wäre. Eine solche Umsetzung wäre mit geringerem bürokratischem Aufwand sowie erheblich transaktionsärmer zu realisieren als die bislang vorgesehene bilaterale Abrechnung zwischen pharmazeutischen Herstellern und jeder einzelnen Krankenkasse.
Auch die Regelung, nach der Arzneimittel für seltene Erkrankungen weiterhin einen Sonderstatus genießen, der ihnen per Gesetz – bis zu einer nunmehr abgesenkten Umsatzgrenze – unabhängig von vorliegender Evidenz einen Zusatznutzen zuschreibt, sollte überdacht werden. Es wäre ein Schritt für mehr Transparenz und Bürokratieabbau, diesen Sonderstatus gänzlich zu streichen. Dabei sind entsprechende Schutzzonen nicht zwingend erforderlich, wie frühere Auswertungen gezeigt haben: auch für diese Arzneimittel sind Studien angemessener Qualität nicht generell ausgeschlossen2,3 – im Gegenteil setzt der Sonderstatus den falschen Anreiz, dass es fundierter Evidenz für diese Arzneimittel nicht unbedingt bedarf. Nach der Analyse des IQWiG aus 2021 war die Feststellung eines fiktiven Zusatznutzens in über der Hälfte der Fälle irreführend und bestätigte sich bei der regulären Nutzenbewertung nicht. Das damit entstehende verzerrte Bild über ein neues Orphan Drug, so die Schlussfolgerung, führe nicht nur zur irreführenden Kommunikation, sondern benachteilige auch bereits vorhandene Therapieoptionen, die durch den fiktiven Zusatznutzen für das neue Präparat schlechter gestellt werden. Denn schließlich haben alle Patientinnen und Patienten, auch solche mit einem seltenen Leiden, einen Anspruch auf möglichst hochwertige Evidenz und Transparenz. Nicht zuletzt schafft die Regelung unnötige Verwaltungsaufwände durch das Controlling von Umsätzen im ambulanten und stationären Bereich und riskiert Verfahren in kurzer Folge, wenn die Umsatzgrenze zeitnah nach Marktzugang erreicht wird.
Mit dem GKV-FinStG wurde die langjährige Forderung der GKV zur Rückwirkung des Erstattungsbetrags zumindest teilweise erfüllt, indem der ausgehandelte Erstattungsbetrag nicht erst nach einem Jahr, sondern bereits ab dem siebten Monat nach Marktzugang bzw. Zulassungserweiterung gilt. Damit ist im ersten halben Jahr weiterhin der vom pharmazeutischen Unternehmen geforderte Preis zu berücksichtigen. Zwar sind die hier umgesetzten Summen üblicherweise nicht erheblich, jedoch geht das Arzneimittel mit dem frei gewählten Preis in die Erstattungsbetragsverhandlungen ein, der faktisch wie ein Preisanker wirkt. Zusammen mit weiteren Parametern wie den Preisen vergleichbarer Arzneimittel und denen für das neue Arzneimittel im europäischen Ausland führt dies zur überhöhten Steigerung indikationsspezifischer Preisniveaus. Denn auch wenn im Ausland Arzneimittel von den dortigen Kostenträgern günstiger eingekauft werden können, so sind diese Preise üblicherweise vertraulich und damit für die Verhandlungen zum Erstattungsbetrag in Deutschland nicht verfügbar. Politisch anders intendiert, gehen bislang bei den Arzneimitteln mit attestiertem Zusatznutzen mehrheitlich preistreibende Faktoren in die Erstattungsbetragsverhandlungen ein.
Höchstpreise bei Arzneimitteln: ob man verdient, was man verdient…
Die Frage, welche Preise für neue Arzneimittel angemessen sind, hängt wesentlich von der Perspektive des Befragten ab. Aus Sicht der Kostenträger sind die immer weiter ansteigenden Preise bei neuen Arzneimitteln nicht nachvollziehbar. Lange Zeit wurde auf teure Forschungs- und Entwicklungskosten sowie gescheiterte Projekte in der Arzneimittelforschung als Rechtfertigung für hohe Preise bei neuen Arzneimitteln verwiesen. Dies wird jedoch inzwischen kritisch hinterfragt.4 Pharmazeutische Unternehmen profitieren bei der Arzneimittelentwicklung nicht selten von Ergebnissen öffentlich finanzierter Forschung, was sich jedoch nicht im Preis widerspiegelt.5 Damit bezahlen Versicherte, die bereits über Steuern oder auch Spenden entsprechende Forschungsvorhaben unterstützt haben, den Forschungserfolg beim Einsatz einer Neuentwicklung nochmals. Gerade bei hochpreisigen Gentherapien, die mit immer kürzeren Entwicklungszyklen und zum Teil Studien mit geringen Fallzahlen in kürzester Zeit eine Zulassung erhalten, zeigt sich ein deutliches Missverhältnis von tatsächlichem Forschungsinvestment und erwartetem Ertrag. Dabei kann es auch nicht legitim sein, dass die Versichertengemeinschaft überhöhte Preise aufgrund von Aufkäufen entsprechender Entwicklungen durch große Pharmafirmen refinanzieren muss.
Inzwischen wird die Preisbildung eines neuen Arzneimittels mit dem besonderen Nutzen des Präparats vor allem für die Betroffenen begründet.5 Im Kontext der „antizipierten“ Zahlungsbereitschaft der Gesellschaft v.a. für bestimmte Personengruppen und Erkrankungsbilder, wie bspw. neue Krebstherapien oder auch Arzneimittel für Kinder, sind hohe Preise leichter durchsetzbar. Ungelöst bleibt, dass der schnelle und ungehindert breite Marktzugang in Deutschland auf Basis geringer Evidenz eigentlich zu Preisabschlägen führen müsste: Schließlich wird die weitere Evidenzgenerierung nicht mehr durch Studien zulasten des pharmazeutischen Unternehmers, sondern von der Versichertengemeinschaft übernommen. Statt mit niedrigeren Einstiegspreisen sieht sich der deutsche Markt jedoch mit besonders hohen Preisen für neue Arzneimittel konfrontiert.6 Verwiesen wird dabei auch auf die Praxis der Preisreferenzierung in Ländern, nach der ein hoher Arzneimittelpreis in Deutschland zwingend sei, um auch in anderen Ländern angemessene Margen zu erzielen und eine Marktrücknahme in Deutschland zu verhindern.7
Irrweg vertraulicher Erstattungsbetrag
Von pharmazeutischen Herstellern wird in diesem Zuge seit Jahren für einen vertraulichen Erstattungsbetrag geworben, wie ihn vormals auch der Referentenentwurf des Gesetzes zur Stärkung der Arzneimittelversorgung vorgesehen hatte8: Unter der Vertraulichkeit könne – wie in anderen Ländern auch – ein größerer Abschlag auf den herstellerseitigen Wunschpreis gewährt werden, da die Vertraulichkeit ohne Folgewirkungen durch die staatenübergreifende Preisreferenzierung bleibe. Bereits damals hatte man das Vorhaben zurecht wieder verworfen, denn die erhoffte ausgabendämpfende Wirkung ist kaum zu erwarten: Intransparenz von Preisen dürfte aus vielerlei Gründen vielmehr ausgabensteigernd wirken, nicht zuletzt, weil diese nicht mehr dem öffentlichen Diskurs unterliegen. Für die Kostenträger wären – sollten pharmazeutische Unternehmen ihre Arzneimittel nicht auf Kommissionsbasis in den Handel abgeben und die Erstattung direkt mit dem eingeweihten Kostenträger vollziehen – überhöhte Handelsmargen zu tragen. Damit droht eine deutliche Liquiditätsverschiebung zulasten der GKV, die mit den notwendigen Nacherstattungen zudem mit erheblichem Transaktionsaufwand belastet würde. Nach den aktuell bekannten Entwürfen für eine „neue Pharmastrategie“ der Bundesregierung gibt es jedoch offenbar erneut die Bereitschaft, diesen Weg zugunsten der pharmazeutischen Hersteller zu gehen – trotz der drohenden Mehrkosten, die diese Maßnahme für die angesichts von gravierenden Preisanhebungen in allen Marktbereichen ohnehin schon stark belasteten Versicherten mit sich bringen dürfte.
Dass andere Staaten große Abschläge auf Arzneimittelpreise aushandeln können, dürfte ohnehin kaum an der Vertraulichkeit der Preise liegen, sondern vielmehr an der andernorts üblichen 4. Hürde: Dort können die Kostenträger – anders als die deutsche GKV – entscheiden, Präparate ganz oder teilweise gar nicht erst in den Leistungskatalog aufzunehmen, wenn sie dies für sinnvoller erachten und man bei den Preisvorstellungen nicht zusammenkommt. Erst mit diesem Wahlrecht entstehen „gleichlange Spieße“ beider Vereinbarungspartner um ausgewogene Preise. Die Parität in der Verhandlungssituation in Deutschland wird ein vertraulicher Erstattungsbetrag daher nicht unterstützen – im Gegenteil; im Ergebnis dürfte die intendierte Kostenneutralität nicht realistisch sein. Dies gilt umso mehr, wenn für die Ärztinnen und Ärzte angesichts vertraulicher Erstattungsbeträge die wirtschaftliche Verordnung im Therapiegebiet gar nicht mehr ablesbar ist.
In jedem Fall dürfte das bestehende System der Erstattungsbetragsverhandlungen mit seiner auf Preisvergleichen beruhenden Ableitung des Erstattungsbetrags bei Realisierung der Vertraulichkeit obsolet sein: Ohne entsprechende Informationen zum tatsächlichen Preisgefüge kann weder der G-BA eine wirtschaftliche zweckmäßige Vergleichstherapie bestimmen noch können Verhandlungen auf eine solche aufbauen. Damit wäre eine Neudefinition der Parameter zum Erstattungsbetrag zwingend. Gleiches gilt auch, sollte sich letztendlich ein angemessenes Preisniveau im Patentarzneimittelmarkt auch mit den neuen Leitplanken als nicht realistisch erweisen.
Eine solche Alternative könnte ein stärker kostenbasierter Ansatz sein, mit dem ein angemessener Erstattungsbetrag unabhängig von den Preisen anderer Arzneimittel abgeleitet werden kann. Die AIM hat in ihrem „Fair-price-Model“9 als Parameter für eine Verhandlung neben der Berücksichtigung von Kosten für Forschung, Entwicklung, Produktion, Verkauf und Information auch Aufschläge für einen Basisgewinn sowie eine Incentivierung der Innovation des neuen Arzneimittels vorgeschlagen. Grundsätzlich wären diese Faktoren auch für eine Weiterentwicklung der Erstattungsbetragsverhandlungen geeignet, wobei die für den deutschen Markt angemessenen Verhandlungskorridore politisch festzulegen wären.
Rezepte gegen Höchstpreise
Auch im bestehenden System wäre die vom Gesetzgeber gewünschte Korrektur überhöhter Preise im Patentmarkt mit wenigen Anpassungen leichter umsetzbar, wenn bereits der Markteinstieg einbezogen würde: Mit einem Interimspreis als vorläufige Abrechnungsgröße, der jedem neuen Arzneimittel vor Marktzugang zugeteilt wird, wären die Erstattungsbetragsverhandlungen nicht mehr mit dem Wunschpreis des pharmazeutischen Unternehmens prädisponiert. Der Interimspreis wäre vom GKV-Spitzenverband in einem transparenten Verfahren aus der zuvor vom Gemeinsamen Bundesausschuss festgelegten zweckmäßigen Vergleichstherapie abzuleiten und würde ab dem ersten Tag im Markt gelten. Mit Straffung der Erstattungsbetragsverhandlungen auf drei Monate könnte der resultierende Erstattungsbetrag nach neun Monaten den Interimspreis rückwirkend ersetzen (siehe Abbildung 1).
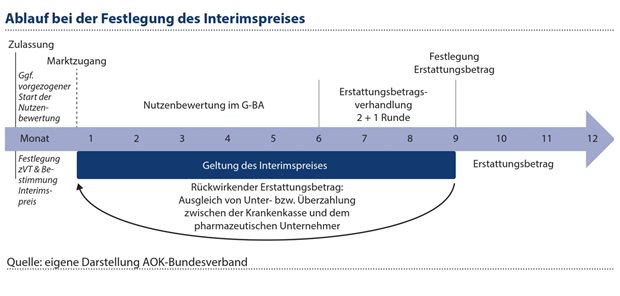
Abbildung 1: Mit einem Interimspreis als vorläufige Abrechnungsgröße wären die Erstattungsbetragsverhandlungen nicht mehr durch den Wunschpreis des pharmazeutischen Unternehmens vorgeprägt.
© SMV
Dabei wären in den Erstattungsbetragsverhandlungen lediglich das Ergebnis der frühen Nutzenbewertung des G-BA und der Preis der zweckmäßigen Vergleichstherapie einzubeziehen, dazu auch anfallende Abzüge für Kombinationstherapien und Verwürfe. Soweit vom pharmazeutischen Unternehmer ein vorgezogener Start des Nutzenbewertungsverfahrens gewünscht ist und der G-BA diesem im Einzelfall zustimmt, wäre die Zeitspanne bis zur Vereinbarung des Erstattungsbetrags entsprechend verkürzbar. Ein in dieser Weise begleiteter Markteinstieg von neuen Arzneimitteln könnte helfen, überhöhte Preise abzuwenden und zeitnah einen fairen Interessensausgleich zwischen Kostenträgern und pharmazeutischen Unternehmen herzustellen.10
Mehr Wettbewerb auch im Patentmarkt
Und nicht zuletzt sollten weitere Wirtschaftlichkeitsreserven aus der Stärkung des Wettbewerbs im Patentmarkt generiert werden. Bislang ist der Wettbewerbsdruck in diesem Marktsegment gering und findet lediglich auf der Ebene der ärztlichen Verordnung statt. Die vorhandenen Wirtschaftlichkeitsreserven werden für die Kostenträger vor Ablauf des Patents bzw. Unterlagenschutzes erschließbar, wenn ein wirkstoffübergreifender Vertragswettbewerb initiiert werden kann. Hierzu könnte der G-BA für ein Anwendungsgebiet eine Gruppe von Arzneimitteln mit therapeutischer Vergleichbarkeit bestimmen, die als Basis für Selektivvertragsausschreibungen der Krankenkassen mit pharmazeutischen Unternehmern herangezogen werden kann. Die bevorzugte Verordnung durch Ärztinnen und Ärzte erfordert eine entsprechende Abbildung der Vertragsinformationen im Arztinformationssystem.

© privat
Sabine Jablonka ist Apothekerin und Diplom-Biologin. Sie ist seit 2006 beim AOK-Bundesverband, zuletzt als Abteilungsleiterin Arzneimittel im Geschäftsbereich Versorgung. Zuvor war sie in einem Beratungsinstitut mit Projekten in der beruflichen Bildung, der Gesundheitsforschung sowie in der Unternehmensberatung tätig.
Literatur
- Vfa Pressemitteilung 034/2023. https://go.sn.pub/2RwR8f. (Zugegriffen: 01.12.2023)
- Kulig M (2017) Nutzenbewertung von Orphan Drugs trotz unzureichender Evidenz und fehlenden RCT. In: Lücken in der Evidenz – was leisten Registerdaten? Springer-Medizin, Berlin. S 26-34. https://go.sn.pub/eDJfwl. (Zugegriffen: 01.12.2023)
- IQWiG-Bericht Nr. 1269 (2021): Evidenz zu Orohan drugs. https://go.sn.pub/jUzLAN. (Zugegriffen: 01.12.2023
- Bspw. Angelis A et al.,(2023) High drug prices are not justified by industry’s spending on research and development. BMJ 023;380:e071710. http://dx.doi.org/10.1136/bmj-2022-071710
- Bspw. für Zolgensma®: Beckmann S, Schillinger G (2020) Geschäft mit der Hoffnung auf Heilung G+G 02/2020. https://go.sn.pub/zAiM50. (Zugegriffen: 01.12.2023)
- Vogler S (2021) Preisregulierung im internationalen Vergleich. Arzneimittel-Kompass 2021, Kapitel 9, S. 125-138. https://go.sn.pub/5jTdbk (Zugegriffen: 01.12.2023)
- Wasem J Volmer T (2023) AMNOG 2025: Thesen für eine Weiterentwicklung des AMNOG zu einem moderneren, europakompatiblen und patientenzentrierten System der frühen Nutzenbewertung neuer Arzneimitteltherapien. https://go.sn.pub/Es8sWf (Zugegriffen: 01.12.2023)
- Referentenentwurf des BMG (2016) Entwurf eines Gesetzes zur Stärkung der Arzneimittelversorgung in der GKV (GKV-Arzneimittelversorgungsstärkungsgesetz – AM-VSG). https://go.sn.pub/hzVTMW. (Zugegriffen: 01.12.2023)
- A. Hendrickx, T. Kanga-Tona (2021) Ein transparentes Modell für einen fairen Preis für innovative Arzneimittel. Arzneimittel-Kompass 2021, Kapitel 11, S. 155-173. https://go.sn.pub/d1jhqS. (Zugegriffen: 01.12.2023)
- Jablonka S, Bogum J, Opitz G. (2021). Ein neuer Weg zu fairen Preisen. G+G 06/2021. https://go.sn.pub/ELkpOX. (Zugegriffen: 01.12.2023)




