AMNOG-Verfahren: Plädoyer für ein Update
In der Medizin werden Therapien zunehmend stärker auf die individuellen molekularen und immunologischen Eigenschaften zugeschnitten. Dadurch verändern sich auch die Bedingungen für die Durchführung klinischer Studien. Klassische, randomisiert-kontrollierte Studien sind nicht immer durchführbar. Dies wird von den Zulassungsbehörden auch berücksichtigt, stellt aber die Nutzenbewertung im Rahmen des bewährten AMNOG-Verfahrens vor Probleme. Es besteht also Handlungsbedarf.
Veröffentlicht:Randomisierte, kontrollierte Studien (RCTs) sind der Goldstandard für die Bewertung von Effektivität und Sicherheit medizinischer Therapien. Sie haben sich über Jahrzehnte bewährt und bilden die Grundlage nicht nur der arzneimittelrechtlichen Zulassung, sondern auch des nachgelagerten Health-Technology-Assessments (HTA), in Deutschland im Rahmen der Nutzenbewertung als Teil des AMNOG („Arzneimittelmarkt-Neuordnungsgesetz“)-Verfahrens.
Mehr Flexibilität im AMNOG erforderlich
Mit dem AMNOG-Verfahren [1] war Deutschland international ein Vorreiter. Es hat sich in den vergangenen zwölf Jahren bewährt. Aber es ist jetzt mit denselben dynamischen Veränderungen im Umgang mit begründbaren Evidenzunsicherheiten konfrontiert wie die Arzneimittelzulassung: So sind RCTs bei zielgerichteten Therapien, die sehr kleine Patientengruppen betreffen, mitunter nicht durchführbar. Bei schweren Erkrankungen, für die keine Therapien existieren, sind sie unter Umständen ethisch nicht vertretbar. Die Zulassungsbehörden haben hier eine gewisse Flexibilität entwickelt, sie akzeptieren in besonderen Therapiesituationen beispielsweise einarmige Studien und/oder machen es zur Auflage, nachgelagert entsprechende Evidenz zu generieren. Prinzipiell erkennt der rechtliche Rahmen des AMNOG-Verfahrens an, dass es besondere Therapiesituationen gibt, in denen es unmöglich oder unangemessen ist, Studien der höchsten Evidenzstufe durchzuführen. Jedoch fußt die bestehende Bewertungslogik im AMNOG, mit Ausnahme von Orphan Drugs, nach wie vor auf der Vorlage direkt vergleichender Evidenz [2].
Dies hat Folgen: Bereits mehrfach wurden effektive Therapien zur Behandlung schwerwiegender Erkrankungen vom deutschen Markt genommen, da im Rahmen des AMNOG-Verfahrens der für die Erstattungsbetragsverhandlung entscheidende Zusatznutzen auf Basis begründbar limitierter Evidenz nicht belegt werden konnte. Die Konsequenz: Patientinnen und Patienten können unter Umständen mit nachgewiesen wirksamen Medikamenten nicht behandelt werden [3].
Was also tun? Vor dem Hintergrund der dynamischen Veränderungen bei klinischen Studien in den Zeiten zunehmend personalisierter Therapien hat der Branchenverband vfa im Juli 2023 ein Positionspapier vorgelegt, in dem Handlungsfelder für den AMNOG-Prozess benannt werden [4].
Fünf Impulse für den AMNOG-Prozess
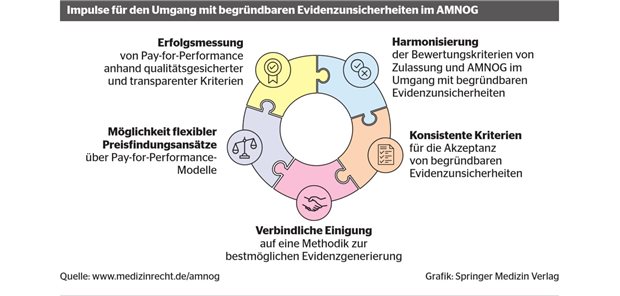
Das Unternehmen Roche hat parallel hierzu eigene Workshops mit externen Experten aus Medizin, Wissenschaft und GKV initiiert, um konkrete Empfehlungen für den Umgang mit begründbaren Evidenzunsicherheiten im AMNOG erarbeiten zu lassen. Daraus ist ein öffentlich zugängliches Impulspapier entstanden [5]. Folgende fünf Denkanstöße werden dort gegeben (s. Abb.):
- Harmonisierung der Bewertungskriterien: Arzneimittelzulassung und Nutzenbewertung sollten im Umgang mit begründbaren Evidenzunsicherheiten besser aufeinander abgestimmt sein.
- Etablierung eines konsentierten Kriterienkatalogs für die Akzeptanz von begründbaren Evidenzunsicherheiten in der Nutzenbewertung: Im AMNOG sollte für besondere Therapiesituationen transparent festgelegt werden, unter welchen Bedingungen welche Art von Evidenz erforderlich und somit akzeptabel ist.
- Verbindliche Festlegung auf eine Methodik zur Generierung des bestmöglichen Evidenzkörpers: Hierzu bedarf es einer frühzeitigen, gemeinsamen Einigung aller beteiligten Parteien.
- Flexibilisierung der Preisfindungsansätze bei individualisierten Therapien: Das AMNOG und alle hieran Beteiligten müssen lernen, mit Unsicherheiten bei der Evidenzlage auch finanziell umzugehen (inklusive der Langzeitwirksamkeit von Einmaltherapien). Hierzu bieten sich Pay-for-Performance-Modelle als optionaler Bestandteil der Erstattungsbetragsverhandlung an.
- Präzisierung der Anforderungen an Pay-for-Performance-Modelle: Die Erfolgsmessung sollte anhand von Daten hoher Qualität in aussagekräftigem Umfang erfolgen, die mit vertretbarem Aufwand erhebbar sein müssen. Eine Einigung und die Transparenz über die Datenerhebung und Datenbewertung ist dabei zwingend notwendig.
© Springer Medizin Verlag GmbH
Fazit
Mehr Dialog tut not, um das AMNOG in enger Abstimmung zwischen Behörden, Institutionen, pharmazeutischen Unternehmen sowie Expertinnen und Experten angesichts der hohen Dynamik des medizinischen Fortschritts gemeinsam weiterzuentwickeln. Es gilt, Kriterien für die Generierung von Evidenz in Situationen mit begründbarer Evidenzunsicherheit zu definieren und Plattformen zu schaffen, um sich gemeinsam, frühzeitig und einzelfallgerecht auf diese Kriterien zu einigen. Außerdem sollte diskutiert werden, wie zielführende Preisfindungsansätze in solchen Situationen aussehen können. Marktrücknahmen als Folge fehlenden Konsenses über Methodiken und/oder Bepreisung gilt es, im Interesse der Patientinnen und Patienten, zu vermeiden.
„Die Methoden müssen wir nicht mehr erfinden“
Welche Möglichkeiten gibt es, in Situationen begründbarer Evidenzunsicherheit trotzdem gute Evidenz zu generieren? Und wie lässt sich das im AMNOG-Prozess verankern? Fragen an Professor Tim Friede, Direktor des Instituts für Medizinische Statistik, Universitätsmedizin Göttingen.
Die klinische Forschung ist im Wandel. Wir sehen eine zunehmende Personalisierung, wir sehen neue Therapien wie Zell- und Gentherapie. Was sind da die Herausforderungen für den AMNOG-Prozess?

© Universitätsmedizin Göttingen (UMG)
Eine Grundidee ist ja, die Therapien mit geeigneten Markern spezifischer zu gestalten, sie stärker auf die Bedürfnisse der Patientinnen und Patienten abzustimmen. Das ist zunächst einmal gut. Die Frage ist: Wie evaluieren wir solche Therapien, die dann unter Umständen relativ kleine Patientengruppen adressieren? Wenn wir den Evidenzgrad nicht absenken wollen, müssen wir versuchen, gute Evidenz anders zu generieren. Das betrifft die Arzneimittelzulassung, insbesondere aber im Nachgang die frühe Nutzenbewertung, die andere Anforderungen an Kontrollgruppen und Endpunkte stellt. Ein Beispiel sind Zulassungen auf Basis einarmiger Studien, bei denen mit externen, für eine Nutzenbewertung nicht hinreichenden Kontrollen verglichen wurde. Ein anderes Beispiel sind Zulassungen auf Basis von Endpunkten, die sich an Wirkmechanismen orientieren. Das macht eine Nutzenbewertung auch schwierig.
Welche methodischen Möglichkeiten der Evidenzgenerierung gibt es, wenn klassische, randomisiert-kontrollierte Studien (RCTs) schwierig durchführbar sind?
Die Palette ist relativ breit, da hat sich in den letzten zehn Jahren methodisch einiges getan, auch dank der Forschung zu seltenen Erkrankungen. Es gab auf EU-Ebene drei Konsortien zu solchen Themen, ASTERIX, IDeAl und InSPiRE. An InSPiRE waren wir selbst beteiligt. Methoden, die dort geprüft wurden, waren z. B. adaptive Designs und integrierte Studiendesigns über traditionelle Entwicklungsphasen hinweg. Ein anderer Themenblock ist die Evidenzsynthese: Wie fasst man Ergebnisse von Studien mit unterschiedlichen Designs zusammen? Zum Beispiel können kleine RCTs gemeinsam ausgewertet werden mit Daten aus Registern. So kann in einer RCT die Kontrollgruppe kleingehalten werden. Wir haben dazu bei uns viel gearbeitet, erste Implementierungen laufen.
Was, wenn gar keine RCT möglich ist? Wenn eine Zulassung auf Basis einer einarmigen Studie erfolgt?
Ohne randomisierten Vergleich stellt sich die Frage, wie man mit Confoundern umgeht. Das einfachste sind Regressionsmodelle, in denen man kovariat adjustiert. Es gibt Propensity-Score-adjustierte Methoden. Auch hier hat sich methodisch viel getan, allerdings vor allem im Kontext großer Fallzahlen.
Der zweite Punkt, der hier relevant ist, ist die Datenqualität. Die ist bei externen Kontrollen oft nicht in dem Maße gewährleistet wie bei einer RCT.
Eine andere Frage ist, wie es auf Ebene der Zulassung weitergeht mit den einarmigen Studien.
Prinzipiell sollten wir vom Schwarz-Weiß-Denken wegkommen. Es gibt nicht nur maximal gepowerte RCT auf der einen und unkontrollierte Studien auf der anderen Seite. Dazwischen ist noch viel Spielraum. Es kann simultan ein Register aufgebaut werden, wenn absehbar ist, dass man mit der Randomisierung Probleme hat. Es können auf Registerebene Designs flexibilisiert werden, z. B. ein RCT in eine Registerstruktur eingebettet werden. Es gibt auch die Option nicht-randomisierter, aber immer noch kontrollierter Studien. Wir haben das bei einer kardiologischen ICD (implantierbarer Kardioverter/Defibrillator)-Studie gemacht und dabei im Studiendesign ausgenutzt, dass die Versorgungssituation innerhalb Europas unterschiedlich ist. Da muss im Einzelfall geschaut werden, was machbar und zweckmäßig ist.
Was heißt das alles konkret für den AMNOG-Prozess und dessen Akteure? Bessere Leitfäden, mehr frühe Beratung? Strukturierte Abstimmungsrunden mit den Herstellern?
Früher und konkreter miteinander zu reden, ist wichtig. Wir brauchen außerdem auf allen Ebenen ein Umdenken, nicht nur bei G-BA (Gemeinsamer Bundesausschuss) und IQWiG (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen), sondern auch bei den Herstellern. Die statistischen Methoden müssen wir nicht mehr erfinden, die sind da. Wir müssen jetzt dringend konkrete Erfahrungen mit alternativen Möglichkeiten der Evidenzgenerierung sammeln. Es gibt zum Beispiel das Sandbox-Konzept, das ist genau dafür sehr interessant. Bei diesem Konzept werden neue Wege der Evidenzgenerierung im Zulassungskontext, sozusagen im Sandkasten, gemeinsam von Behörden und Unternehmen ausprobiert und evaluiert. Es ist doch so: Alle Akteure haben ein Interesse daran, Erfahrungen zu sammeln. Dann sollten wir das auch ermöglichen.
Das Sandbox-Konzept geht zurück auf den Entwurf der neuen EU Pharma Legislation, dort allerdings in Bezug auf das Zulassungsverfahren. Könnte so etwas auch die Nutzenbewertung voranbringen?
Absolut. Es ist im Interesse aller Beteiligten, dass Zulassung und Nutzenbewertung aufeinander aufbauen. Entsprechend sollten auch solche experimentellen Szenarien ineinandergreifen. Die Grundidee ist ja, die Nutzenbewertung von Beginn an mitzudenken und eben nicht erst nach der Zulassung. Natürlich ist die Nutzenbewertung im Moment eine nationale Angelegenheit, anders als die Zulassung. Aber da gibt es ja durchaus Ansätze, das weiterzudenken.
Wo, wenn nicht im Rahmen eines solchen Sandbox-Ansatzes, soll das denn sonst ausprobiert werden? Ich halte das für eine tolle Gelegenheit, die Nutzenbewertung im regulatorischen Gesamtkontext endlich mal relativ früh zu berücksichtigen.
Literatur
1. https://www.g-ba.de/themen/arzneimittel/arzneimittel-richtlinie-anlagen/nutzenbewertung-35a (letzter Zugriff: 20.11.2023)
2. https://www.thieme-connect.com/products/ejournals/abstract/10.1055/a-2142-0794 (letzter Zugriff: 20.11.2023)
3. https://www.vfa.de/download/stellungnahme-evaluation-gkvfinstg (letzter Zugriff: 20.11.2023)
4. https://www.vfa.de/download/amnog-2025-aktuelle-handlungsfelder.pdf (letzter Zugriff: 20.11.2023)
5. www.medizinrecht.de/amnog (letzter Zugriff: 20.11.2023)
Impressum
„AMNOG-Verfahren: Plädoyer für ein Update“
Literaturarbeit
Bericht: Philipp Grätzel von Grätz, Berlin
Artikel gedruckt in: Ärzte Zeitung Nr. 49, 7. Dezember 2023
Mit freundlicher Unterstützung der Roche Pharma AG, Grenzach-Wyhlen
Corporate Publishing (verantwortl. i. S. v. § 55 Abs. 2 RStV):
Ulrike Hafner, Tiergartenstraße 17, 69121 Heidelberg
Redaktion: Dr. Tobias Berenz
Springer Medizin Verlag GmbH, Heidelberger Platz 3, 14197 Berlin
Tel: +49 (0) 61 02 / 506 – 0
Fax: +49 (0) 61 02 / 506 – 203
E-Mail: info@aerztezeitung.de
Die Springer Medizin Verlag GmbH ist Teil der Fachverlagsgruppe Springer Nature
Geschäftsführung: Fabian Kaufmann, Dr. Cécile Mack, Dr. Hendrik Pugge
Handelsregister Amtsgericht Berlin-Charlottenburg HRB 167094 B
Umsatzsteueridentifikationsnummer: DE 230026696
© Springer Medizin Verlag GmbH
Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und Markenschutz-Gesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürfen. Für Angaben über Dosierungsanweisungen und Applikationsformen kann vom Verlag keine Gewähr übernommen werden. Derartige Angaben müssen vom jeweiligen Anwender im Einzelfall anhand anderer Literaturstellen auf ihre Richtigkeit überprüft werden.