Zusammenspiel von HTA und Zulassung
Chronische Erkrankungen im AMNOG – verlässliche Rahmenbedingungen für Innovationen gesucht
Auf der Basis einer Analyse von 849 AMNOG-Verfahren zeigt sich, dass insbesondere chronische Erkrankungen in der AMNOG-Methodik benachteiligt sin
Veröffentlicht:
© Mutshino_Artwork - stock.adobe.com
Einleitung
Nutzenbewertungsverfahren wurde als lernendes System konzipiert, um sich ständig ändernden Bedingungen anzupassen. Legt man diesen Anspruch zugrunde, muss eine sinnvolle Novellierung der Nutzenbewertung die Bedürfnisse von Menschen mit chronischen Erkrankungen stärker berücksichtigen. Mit dem GKV-Finanzstabilisierungsgesetz (GKV-FinStG) wurde 2023 jedoch primär auf die Kostensituation der gesetzlichen Krankenversicherungen reagiert und die Parameter für die Preisfindung im Nutzenbewertungsverfahren geändert, was die Lage für Arzneimittel zur Behandlung chronischer Erkrankungen weiter deutlich belastet.
Wünschenswert wäre stattdessen eine Rückbesinnung auf den ursprünglich mit Einführung des Arzneimittelmarkt-Neuordnungsgesetzes (AMNOG) angelegten Gedanken, auf Basis eines hochwertigen Nutzennachweises einen nutzenadjustierten Preis zu verhandeln. Verlässliche Rahmenbedingungen sind die Voraussetzung, um Schrittinnovationen zu entwickeln, die gerade für die Versorgung chronisch kranker Patient:innen von großer Bedeutung sind.
Besonderheiten chronischer Erkrankungen im AMNOG-Verfahren
Seit der Einführung des AMNOG im Jahr 2011 ist das Ziel der frühen Nutzenbewertung, anhand der Beurteilung der Evidenz aus Patientenperspektive eine optimierte Versorgung mit innovativen Arzneimitteln zu gewährleisten. Eine der Kernregelungen war bislang, dass die Erstattung eines Arzneimittels ohne nachgewiesenen Zusatznutzen nicht zu höheren Ausgaben führen darf als die jeweils günstigste Vergleichstherapie. Hierdurch wurde sichergestellt, dass etwaige Mehrausgaben immer mit einem nachgewiesenen Zugewinn an patientenrelevantem Nutzen einhergingen und die Arzneimittelkosten nachvollziehbar über den Zusatznutzen gerechtfertigt werden konnten.
Auf diese Weise ist ein grundsätzlich funktionierendes System aus Nutzenbewertung und Preisverhandlung entstanden, das in der überwiegenden Zahl der Verfahren zu einem Interessenausgleich zwischen dem Spitzenverband der Gesetzlichen Krankenversicherungen (GKV-SV) und den pharmazeutischen Unternehmen und damit über ein einvernehmliches Verhandlungsergebnis zum Erstattungsbetrag führt.

© Cagkan / stock.adobe.com
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Monat Jahr in Heft 19 („Zusammenspiel von HTA und Zulassung“) erschienen.
Bei hochpreisigen Arzneimitteln handelt es sich insbesondere um Biologika oder onkologische Arzneimittel sowie Medikamente zur Behandlung seltener Erkrankungen (Orphan Drugs). Arzneimittel in Indikationen, in denen kurzfristige Effekte zu erzielen sind, haben sehr gute Chancen, einen Zusatznutzen zu erhalten. Dies ist insbesondere in der Onkologie zu beobachten, wo bei fortgeschrittenen Erkrankungen mit vergleichsweise kurzer Studiendauer Effekte auf das Gesamtüberleben nachweisbar sind.
Arzneimittel zur Behandlung chronischer Erkrankungen haben ungleich höhere Hürden zu überwinden. Dies liegt zum einen an der fehlenden Anerkennung von patientenrelevanten Endpunkten (Surrogate), wie sie zum Beispiel in Leitlinien und Disease-Management-Programmen (DMP) verankert sind. Gleichzeitig haben Medikamente zur Behandlung chronischer Erkrankungen auch zum Ziel, Spät- und Folgekomplikationen zu vermeiden, was nur in langfristigen Outcome-Studien dargestellt werden kann. Solche Studien können zum Zeitpunkt der Zulassung aufgrund der langen Studiendauer eines Arzneimittels de facto nicht vorliegen.
Schon früh wurde auf diese spezifischen Hürden verwiesen. In ihrem gemeinsamen Positionspapier „Frühe Nutzenbewertung neuer Arzneimittel 2019 – gerecht und nachhaltig?“ kommen die Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO) und die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) zur übereinstimmenden Bewertung: „Die aktuelle Methodik der frühen Nutzenbewertung kommt vor allem Krankheitsindikationen mit kurzer Lebenserwartung und Arzneimitteln mit Orphan-Drug-Status entgegen. Benachteiligt sind chronische Erkrankungen mit langem Therapie- und Krankheitsverlauf. Diese Ungleichgewichtigkeit wirkt sich langfristig negativ auf die Entwicklung neuer Arzneimittel aus.“1
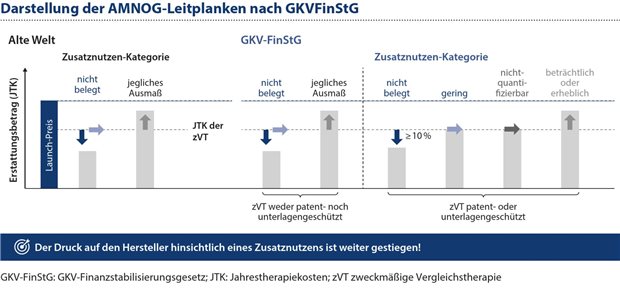
Abbildung 1: Stellt der G-BA eine der beiden Zusatznutzenkategorien „gering“ oder „nicht-quantifizierbar“ fest, dann können Hersteller seit dem GKV-FinStG keinen Preisaufschlag mehr auf die ZVT verhandeln.
© Springer Medizin Verlag
Die Situation hat sich mit dem GKV-FinStG weiter verschärft, indem die Nutzenkategorien von Arzneimitteln mit „geringem“ oder „nicht quantifizierbarem“ Zusatznutzen deutlich abgewertet wurden. Ist die zweckmäßige Vergleichstherapie (ZVT) patentrechtlich geschützt, ist ein obligatorischer Preisnachlass von mindestens 10 Prozent vorgeschrieben, wenn kein Zusatznutzen nachgewiesen worden ist (siehe Abbildung 1). Die Nutzenkategorien„gering“ und „nicht-quantifizierbar“ können keinen Preisaufschlag trotz nachgewiesenen Zusatznutzens auf die ZVT verhandeln.
Damit wird das Prinzip der angemessenen Vergütung insbesondere von Schrittinnovationen auf der Grundlage des zusätzlichen Nutzens untergraben und Anreize für die Entwicklung und Verfügbarkeit neuer Medikamente gerade für chronische Krankheiten limitiert. Das wird sich langfristig auf die Qualität der Versorgung auswirken.
Empirische Analyse bestätigt: Arzneimittel gegen chronische Erkrankungen sind im AMNOG benachteiligt
Im Folgenden werden Ausschnitte aus einer empirischen Analyse dargestellt, die auf Arzneimittel zur Behandlung chronischer Krankheiten im Rahmen der AMNOG-HTA-Bewertungen fokussiert. Alle AMNOG-Verfahren, die zwischen dem AMNOG-Start 01.01.2011 und dem 15.07.2023 abgeschlossen wurden, wurden 849 Verfahren hinsichtlich der Nutzenbewertung analysiert. Für chronische Erkrankung wurde eine Definition des Gemeinsamen Bundesausschusses verwendet.2 Orphan-Drug-Verfahren (n = 250) und Verfahren in onkologischen Indikationen (n = 254) wurden getrennt in ihre spezifischen Kategorien eingeteilt und von chronischen Krankheiten ausgeschlossen.
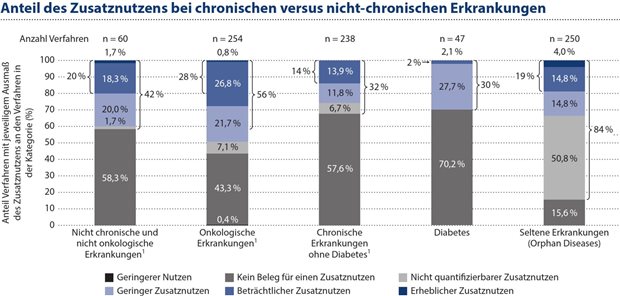
Abbildung 2: Von 47 Nutzenbewertungsverfahren bei Diabetes mellitus-Produkten haben nur 30 Prozent zur Feststellung eines Zusatznutzens geführt. Nur in zwei Prozent der Verfahren wurde ein „erheblicher“ Zusatznutzen festgestellt.
© Springer Medizin Verlag
Ergebnisübersicht zu den Zusatznutzenkategorien, Mortalität und Morbidität sowie der Studiendauer
Medikamente zur Behandlung chronischer Erkrankungen weisen grundsätzlich mit höherer Wahrscheinlichkeit keinen Zusatznutzen in der deutschen HTA-Bewertung auf. Arzneimittel zur Diabetestherapie haben noch geringere Chancen, eine positive Nutzenbewertung zu erzielen.
Von 254 Verfahren bei onkologischen Erkrankungen führen 56 Prozent zu einem Zusatznutzen, von denen 28 Prozent zumindest einen erheblichen Zusatznutzen haben. Von 238 Verfahren bei chronischen Erkrankungen (ohne Berücksichtigung der 47 Verfahren bei diabetischen Erkrankungen) führen 32 Prozent zu einem Zusatznutzen und 14 Prozent zu einem mindestens erheblichen Nutzen. Die Nutzenkategorie „erheblich“ würde einen Preisaufschlag über den Kosten der Vergleichstherapie (nach GKV-FinStG) ermöglichen. Von 47 Diabetes mellitus-Verfahren führen nur 30 Prozent zu einem Zusatznutzen. Im Gegenzug führen nur verschwindend geringe zwei Prozent der Verfahren zu einem erheblichen Zusatznutzen, was die geringste Chance widerspiegelt, nach der neuen Leitplanken-Regelung im GKV-FinStG einen akzeptablen Erstattungsbetrag auszuhandeln (siehe Abbildung 2).
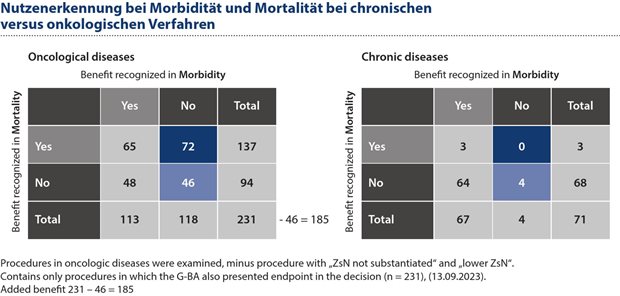
Abbildung 3: Bei 39 Prozent der Verfahren zu onkologischen Produkten sind Mortalitätsvorteile der einzige Treiber für eine positive Nutzenbewertung gewesen, verglichen mit 0 Prozent der Verfahren bei chronischen Erkrankungen.
© Springer Medizin Verlag
Eine HTA- und AMNOG-immanente Herausforderung für die Bewertung von Therapien ergibt sich aus dem relativ langsamen Fortschreiten der chronischen Erkrankungen selbst: Die meisten chronischen Erkrankungen und ihre Symptome entwickeln sich kontinuierlich oder phasenweise über einen langen Zeitraum, manchmal über Jahrzehnte, bis sie zu kritischen Gesundheitszuständen führen.3 Die meisten klinischen Studien im Bereich chronischer Erkrankungen können daher auch bei langer Studiendauer lediglich den Einfluss auf Morbiditätsparameter messen, da sich aufgrund des langsamen Fortschreitens der Erkrankung innerhalb der Studiendauer keine signifikante Mortalitätsunterschiede abzeichnen.
Chronische Erkrankungen zeigen daher eine signifikant reduzierte Nutzenanerkennung innerhalb der Mortalitätskategorie. Die Mortalität ist der dagegen Haupttreiber für positive Nutzenbewertungen bei den onkologischen Verfahren. Bei 74 Prozent (137 von 185) der Verfahren mit anerkanntem Zusatznutzen tragen Mortalitätsvorteile zu einer positiven Nutzenbewertung bei onkologischen Eingriffen bei. Bei chronischen Erkrankungen gab es nur drei Fälle (vier Prozent), in denen ein Mortalitätsvorteil erkannt wurde (3 von 67). Bei 39 Prozent (72 von 185) der onkologischen Eingriffe sind Mortalitätsvorteile der einzige Treiber für eine positive Nutzenbewertung, verglichen mit 0 Prozent bei Eingriffen bei chronischen Erkrankungen (siehe Abbildung 3).
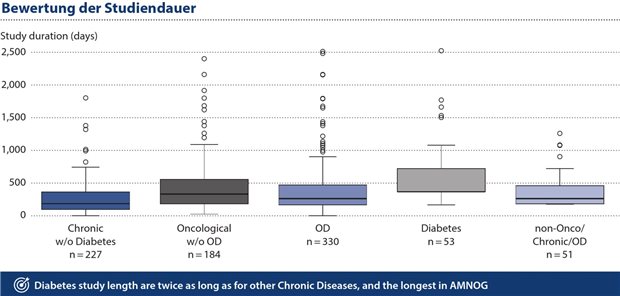
Abbildung 4: Vergleicht man die Studiendauer bei chronischen Erkrankungen, so zeigt sich, dass die Dauer der Studien für Diabetes-Medikamente doppelt so lang ist wie bei anderen chronischen Erkrankungen.
© Springer Medizin Verlag
Diskutiert wird, dass pharmazeutische Hersteller lediglich die Studiendauer bei chronischen Erkrankungen verlängern müssen, um entsprechende Ergebnisse zu zeigen. Dem haben die Unternehmen auch bereits vielfach Rechnung und führen seit Längerem Outcome-Studien durch.
Vergleicht man die Studiendauer bei chronischen Erkrankungen mit der der anderen gebildeten Gruppen (siehe Abbildung 4) zeigt sich, dass die Studiendauer der Diabetes-Studien bereits doppelt so lang ist wie bei den anderen chronischen Erkrankungen und die längste der AMNOG-Prozesse. Allerdings vergehen von Planung, Durchführung und Analyse solcher Outcome-Studien oft sechs bis acht Jahre, d.h. sie stehen in der Regel nicht mit der Zulassung zur Verfügung. Noch längere Studienzeiträume sind nicht abbildbar und nutzen auch nicht dem Prinzip, Innovationen dem Patienten zeitnah zur Verfügung zu stellen.
Drei Empfehlungen zur Weiterentwicklung des AMNOG aus Sicht der chronischen Erkrankungen
Aus den oben dargestellten Analysen ergeben sich mögliche Handlungsfelder, die die besonderen Gegebenheiten der Behandlung von chronischen Erkrankungen im AMNOG berücksichtigen sollen. Drei wesentliche Punkte werden nachfolgend dargestellt.
1. Abschaffung der AMNOG-Leitplanken
Medikamente zur Behandlung chronischer Erkrankungen zeigen in über zehn Jahren AMNOG nur zu ca. zwei Prozent einen beträchtlichen Zusatznutzen, der die Grundlage für eine faire Preisgestaltung im Rahmen der AMNOG-Verhandlungen nach dem GKV-FinStG ist. Dies liegt zum Beispiel bei Diabetes mellitus Typ 2 insbesondere an den erst zeitlich deutlich später durch Outcome-Studien messbaren Spät- und Folgekomplikationen, die unter anderem lange Studiendauern erfordern.
Eine weitere Regelung des GKV-FinStG beinhaltet, dass der fehlende Nachweis der Überlegenheit hinsichtlich patientenrelevanter Endpunkte zu einem Preisabschlag in Höhe von mindestens zehn Prozent führt, falls die ZVT patentgeschützt ist. Neue Arzneimittel werden mit dieser Regelung künftig regelhaft niedriger vergütet als deren patentgeschützte Referenzarzneimittel.
Jenseits des Bruches mit den bisherigen Grundprinzipien der Bildung des Erstattungsbetrages wird vor allem durch die kategorische Ausgestaltung des Gesetzestextes („ist ein Erstattungsbetrag zu vereinbaren“) den Verhandlungspartnern jegliche Möglichkeit genommen, auf besondere Versorgungssituationen zu reagieren. Selbst in einer Situation, bei der Einigungswille auf beiden Seiten bestünde, wäre demnach eine Einigung gesetzlich untersagt. Vor diesem Hintergrund regte der G-BA in seiner Stellungnahme an, „dass Ausnahmen von den zwingenden Vorgaben für die Erstattungsbetragsverhandlungen möglich sein müssen oder flexible „Soll-Regelungen“ in den Paragrafen 130b SGB V aufgenommen werden.“4
Diese Problematik sieht auch Professor Josef Hecken, Unparteiischer Vorsitzender des G-BA. Er schrieb zuletzt in einem Beitrag im AMNOG-Report: „Im Anwendungsbereich einer chronischen Erkrankung ist es wahrscheinlich, dass zur Markteinführung noch keine Langzeitdaten vorliegen und aufgrund der Studienlage nur das Ausmaß eines ‚geringen‘ Zusatznutzens abgeleitet werden kann.“5 Auf einer Veranstaltung ergänzte er, dass die neuen Leitplanken daher „möglicherweise sehr schädlich für die Versorgung von chronisch kranken Patienten sein können“.5 Hecken forderte aufgrund dessen: „Bei chronisch Erkrankten, bei denen durch die Behandlung ein positiver Endpunkt abzusehen ist, wäre ich aber dafür, wenn man von den Leitlinien abweichen dürfte“.6 (Die Leitlinien beziehen sich hierbei auf die Leitplanken-Regelungen im GKV-FinStG).
Die AMNOG-Leitplanken sollten zurückgenommen werden, damit chronische Erkrankungen im Nutzenbewertungsprozess nicht benachteiligt werden und Patient:innen in Deutschland auch künftig von Schrittinnovationen profitieren können.
2. Verbindlichkeit der Beratung
Die frühe Beratung fußt auf einem Rechtsanspruch nach Paragraf 35a Abs. 7 SGB V. Im Rahmen dessen werden frühzeitig relevante Gesichtspunkte für das Studiendesign neuer Arzneimittel (PICOS) für die Nutzenbewertung geklärt. Ebenfalls in Paragraf 35a Abs. 7 SGB V geregelt ist der Anspruch der pharmazeutischen Unternehmen, im Vorfeld der Dossiererstellung eine Beratung beim G-BA insbesondere zur ZVT sowie zu den Unterlagen und Studien, die für die Nutzenbewertung vorzulegen sind, zu erhalten.
Nur mit Kenntnis der ZVT und der darzustellenden Teilpopulationen kann die Vollständigkeit eines Dossiers sichergestellt werden. Ein unvollständiges Dossier hingegen führt zur Nicht-Anerkennung eines Zusatznutzens.
Zugleich bietet eine Abstimmung zu den Anforderungen an das Studiendesign die Möglichkeit, frühzeitig eine relevante Studie für die frühe Nutzenbewertung zu entwickeln und durchzuführen. Daher wird diese Beratung von pharmazeutischen Unternehmen auch regelhaft im Vorfeld der Dossiererstellung bzw. im Rahmen der Studienplanung in Anspruch genommen. Der G-BA interpretiert die hohe Inanspruchnahme der frühen Beratungen als „Hinweis, dass die Hersteller ihr Studiendesign verbessern wollen, um belastbare Daten für die spätere Nutzenbewertung zu generieren“.7
Ungeachtet dieser Notwendigkeit sowie des rechtlichen Anspruchs auf Beratung regelt Kapitel 5 Paragraf 7 Abs 2. Verfahrensordnung G-BA, dass die vom G-BA im Rahmen einer Beratung erteilten Auskünfte nicht verbindlich sind. Der G-BA kann die ZVT im laufenden Verfahren bis zum Zeitpunkt der Beschlussfassung abändern, und damit ein im Vertrauen auf die erteilten Auskünfte erstelltes Dossier wertlos machen. Im Beschluss wird dann der nicht anerkannte Zusatznutzen damit begründet, es seien vom pharmazeutischen Unternehmen keine Daten im Vergleich zur ZVT vorgelegt worden.
Eine womöglich im Zeitverlauf zwischen Beratung und Beschluss notwendige Änderung der ZVT im Zuge neuer wissenschaftlicher Erkenntnisse sollte regelhaft in der Form erfolgen, dass der G-BA eine Erweiterung, nicht aber eine Ersetzung der ZVT vornimmt. Dass eine neuere Therapie die bisherige Therapie umfassend ersetzt, entspricht auch dann nicht der Versorgungsrealität, wenn ein Zusatznutzen vorhanden ist. Insbesondere vor dem Hintergrund der hohen Anforderungen an die lange Studienlaufzeit bei chronischen Erkrankungen würde dies sicherstellen, dass versorgungsrelevante bedeutende Evidenz bei der Nutzenbewertung und der anschließenden Preisverhandlung Berücksichtigung findet.
3. Versorgungsalltag, DMP und Leitlinien bei patientenrelevanten Endpunkten berücksichtigen
Bei der Behandlung chronischer Erkrankungen spielen andere Aspekte eine Rolle als beispielsweise bei der Behandlung akut lebensbedrohlicher Erkrankungen. Bei Letzteren ist das Therapieziel, die Lebenserwartung zu verlängern, bei gleichzeitigem Erhalt oder Verbesserung der Lebensqualität. Therapeutisch kontrollierbare chronische Erkrankungen hingegen gehen in der Regel nicht mit Einschränkungen der Lebensqualität einher, die objektivierbar mit Methoden des AMNOG messbar sind.
Eine Therapie der chronischen Erkrankungen beansprucht daher oft nicht, direkt bei Patientinnen und Patienten erlebbare Effekte zu bewirken. Vielmehr geht es darum, leitliniengerechte Zielwerte zu erreichen, um in der Zukunft liegende negative Ereignisse, wie zum Beispiel einen Myokardinfarkt, zu vermeiden und die jeweiligen Therapieziele unter weitestmöglicher Vermeidung unerwünschter Therapieeffekte langfristig einzuhalten.
Eine leitliniengerechte Therapie chronischer Erkrankungen richtet sich oftmals an diesen Zielwerten aus, die in der Nutzenbewertung als Surrogate bezeichnet werden. Diese für Zulassung, Leitlinien und DMP relevanten Therapieparameter werden in der Nutzenbewertung jedoch als nicht relevant für die Patientinnen und Patienten eingestuft und damit vollständig ignoriert.
So empfiehlt die aktuelle Nationale Versorgungsleitlinie (NVL) Diabetes auf Grundlage der derzeit vorliegenden Evidenz, die Reduktion diabetesbedingter Folgeerkrankungen primär durch die Kontrolle des HbA1c als Surrogat für die Stoffwechseleinstellung zu erreichen.8 Auch das der evidenzbasierten Medizin verpflichtete DMP Diabetes empfiehlt HbA1c-Zielwerte, deren Einhaltung in Qualitätssicherung der DMP nachgehalten wird. Die Techniker Krankenkasse (TK) schreibt in ihrem Evaluationsbericht zum DMP Diabetes: „Es gilt heute als gesichert, dass eine gute Blutzuckereinstellung das Risiko des Auftretens diabetesbezogener mikroangiopathischer Spätschäden (Retinopathie, Nephropathie, Neuropathie) bzw. deren Fortschreiten maßgeblich reduziert.“9
Eine ähnliche behandlungspraktische Ausrichtung an Surrogatparametern erfolgt auch bei vielen weiteren chronischen Erkrankungen wie zum Beispiel Hypertonie, Nierenerkrankungen und neurologische Erkrankungen.
Um die strukturellen Probleme zu beheben, mit denen Arzneimittel zur Behandlung chronischer Erkrankungen in der Nutzenbewertung konfrontiert sind, und eine adäquate und faire Bewertung ihres Nutzens zu ermöglichen, sollte die Festlegung patientenrelevanter Endpunkte nicht im Konflikt mit definierten Behandlungszielen erfolgen. Stattdessen sollte der Nutzen dieser Arzneimittel daran bemessen werden, wie gut sie ihren therapeutischen Zweck erfüllen und therapiesteuernde bzw. gemäß evidenzbasierten Leitlinien anzustrebende Endpunkte (zum Beispiel Erreichung von HbA1c-Zielbereichen unter Vermeidung von Hypoglykämien, Reduzierung von Gewicht, Erlangung von Zielbereichen für Blutdruck, Blutfettwerten, etc.) erreichen.
Fazit
Rücknahme der AMNOG-Leitplanken des GKV-FinStG, da Schrittinnovationen abgewertet werden, die bei chronischen Erkrankungen die Grundlage und Regel für den therapeutischen Fortschritt darstellen.
Verlässlichkeit bei der Entwicklung von Therapien für chronische Erkrankungen durch ergänzende Darstellung der bei der G-BA-Beratung festgelegten ZVT, falls diese aufgrund neuer wissenschaftlicher Erkenntnisse nicht mehr Teil der ZVT ist.

© Novo Nordisk
Tobias Gemmel, Vice President Market Access & Strategic Pricing. Nach dem Studium zum Wirtschafts-Ingenieur Start in die Industrie bei Nestlé - seit 15 Jahren bei Novo Nordisk, seit 2017 im Bereich Market Access & Pricing mit dem Fokus auf „Early Pipeline“. Im Zeitraum von 2020-2022 Leitung der Abteilung External Affairs verantwortlich für den Bereich regionaler Market Access und Public Affairs. Seit Anfang 2022 Leitung der Abteilung Market Access & Pricing für das gesamte Portfolio von Novo Nordisk.

© Privat
Dr. Eberhard Lüdtke, Director National Market Access. Nach Studium der Pharmazie und Promotion Eintritt in die Pharmaindustrie 1992 als Junior-Produktmanager bei der Desitin GmbH. 1995 Wechsel zur Lundbeck GmbH in den Bereich Marketing, ab 1998 Marketingleiter. Ab 2011 Fokus auf AMNOG und Durchführung von Nutzenbewertungen inklusive Preisverhandlungen. Oktober 2017 Wechsel zu IGES als Senior Advisor Market Access. Seit April 2018 Director National Market Access bei der Novo Nordisk Pharma GmbH und verantwortlich für die AMNOG-Prozesse.
Literatur
1 Deutsche Gesellschaft für Hämatologie und medizinische Onkologie, Positionspapier: Frühe Nutzenbewertung neuer Arzneimittel 2019: Gerecht und nachhaltig?, 2019.
2 Gemeinsamer Bundesausschuss, Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V Dulaglutid (Erneute Nutzenbewertung aufgrund neuer wissenschaftlicher Erkenntnisse gem. §13: Diabetes mellitus Typ 2), 2020.
3 Güthlin, C., Köhler, S. & Dieckelmann, M. 2020. Chronisch krank sein in Deutschland : Zahlen, Fakten und Versorgungserfahrungen. Frankfurt am Main: Goethe-Universität, Frankfurt am Main, Institut für Allgemeinmedizin.
4 Gemeinsamer Bundesausschuss, Stellungnahme der hauptamtlichen unparteiischen Mitglieder des Gemeinsamen Bundesausschusses (G-BA) vom 23.09.2022 zur öffentlichen Anhörung des Ausschusses für Gesundheit des Deutschen Bundestages zum Gesetzentwurf der Bundesregierung: Entwurfs eines Gesetzes zur finanziellen Stabilisierung der gesetzlichen Krankenversicherung (GKV-Finanzstabilisierungsgesetz – GKV-FinStG). BT-Drs. 20/3448, 2022.
5 Prof. Dr. Wolfgang Greiner, Dr. Julian Witte, Daniel Gensorowsky, Jana Diekmannshemke, AMNOG-Report 2023: Das GKV-Stabilisierungsgesetz und seine Auswirkungen. Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 43), 2023.
6 Tagespiegel Background, GKV-Stabilisierungsgesetz: Hecken „nervös wegen Versorgung“. https://background.tagesspiegel.de/gesundheit/hecken-nervoes-wegen-versorgung (accessed 16 May 2023).
7 Gemeinsamer Bundesausschuss, Frühe Nutzenbewertung bei neuen Arzneimitteln 2021: G-BA stellt Rekord mit 146 abgeschlossenen Verfahren auf.
8 Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V., Nationale Versorgungsleitlinien: Typ-2-Diabetes Teilpublikation der Langfassung. 2. Auflage, Version 1, AWMF-Register-Nr. nvl-001.
8 Berendes A., Ruth T., Dr. Münscher C., Potthoff F., Ergebnisbericht zum Disease Management Programm Diabetes mellitus Typ 2: der Techniker Krankenkasse in der Region Niedersachsen. Evaluationsbericht zum 30.09.2013, 2013.