Plattform zur Nutzenbewertung – No. 18
Das niederländische HTA-System für hochpreisige Arzneimittel im Krankenhaus
In den Niederlanden gibt es ein obligatorisches soziales Krankenversicherungssystem mit einem relativ großzügigen Grundleistungspaket. Um dem Problem von hochpreisigen Arzneimitteln zur stationären Behandlung zu begegnen, hat die niederländische Regierung ein Sperrverfahren (das sogenannte „Lock-Verfahren“) für die Verwaltung des Marktzugangs (Market Access Management) eingeführt. Bei Arzneimitteln, die bestimmte Schwellenwerte für die Kosten pro Patient und/oder die Auswirkungen auf das Budget überschreiten, müssen die Entwickler neben dem klinischen Dossier ein umfassendes pharmakoökonomisches Dossier einreichen. Die anschließende Bewertung erfolgt durch das Zorginstituut Netherlands (ZIN), wobei die „Kosten pro QALY“ (qualitätsadjustierte Lebensjahre) einer Intervention mit einem Schwellenwert verglichen werden, der mit zunehmender Schwere der Erkrankung steigt. Die endgültigen Preisverhandlungen werden von einem Team des Gesundheitsministeriums geführt. Konzeptionell geht das ZIN schrittweise zu einem risikobasierten und zyklischen HTA-System über.
Veröffentlicht:
© picture alliance / Hollandse Hoogte

© cacaroot / stock.adobe.com | Springer Medizin Verlag
AMNOG2.0 - Auf dem Weg zu einem effizienten System (4504 kB)
In den Niederlanden gibt es ein obligatorisches soziales Krankenversicherungssystem mit einem relativ großzügigen Grundleistungspaket. Dieses offene System ermöglicht es, dass über 90 Prozent der Dienstleistungen und Technologien in das Leistungspaket aufgenommen werden können, ohne dass eine formelle Gesundheitstechnologiebewertung (HTA) oder eine nationale Entscheidung zur Erstattung erforderlich ist.
Wenn Ärzte die Wirksamkeit einer Leistung oder Technologie für ausreichend erwiesen halten und das Nutzen-Risiko-Verhältnis positiv ist, können sie diese anbieten. Dann sind Verhandlungen mit den einzelnen Krankenkassen über die Erstattung erforderlich. Nur wenn eine Leistung oder Technologie ein erhebliches zusätzliches Budget erfordert, muss ein Antrag auf einen neuen Zahlungscode gestellt werden. In solchen Fällen kann sich die Entscheidung auf ein formelles HTA stützen, das vom niederländischen HTA-Gremium, dem Zorginstituut Netherlands (ZIN), durchgeführt wird.
Das offene Zuflussverfahren sieht drei Ausnahmen vor, die eine obligatorische Gesundheitstechnologiebewertung (HTA) erfordern: bestimmte Arzneimittel (siehe Abbildung 1), das nationale Impfprogramm und das nationale Screening-Programm. Die Erstattung hochpreisiger Arzneimittel zur stationären Behandlung, insbesondere onkologischer Medikamente, stellt eine große Herausforderung dar, da sie einen wachsenden Teil des Krankenhausbudgets in Anspruch nimmt. Um dieses Problem anzugehen, hat die niederländische Regierung das sogenannte „Lock-Verfahren“ für die Verwaltung des Marktzugangs eingeführt. Medikamente werden in die „Sperre“ aufgenommen, wenn sie bestimmte Kriterien erfüllen:1
- Wenn die Gesamtkosten für eine neue Indikation oder für mehrere neue Indikationen zusammen voraussichtlich mehr als 20 Millionen Euro pro Jahr betragen, werden alle neuen und künftigen Indikationen in die Sperre aufgenommen (vor dem 1. Juli 2023 waren dies mehr als 40 Millionen Euro);
- Wenn die Gesamtkosten für eine neue Indikation voraussichtlich ≥ 50.000 Euro pro Patient und Jahr UND die Gesamtkosten voraussichtlich > 10 Millionen Euro pro Jahr betragen, wird die Indikation in das Sperrverfahren aufgenommen.
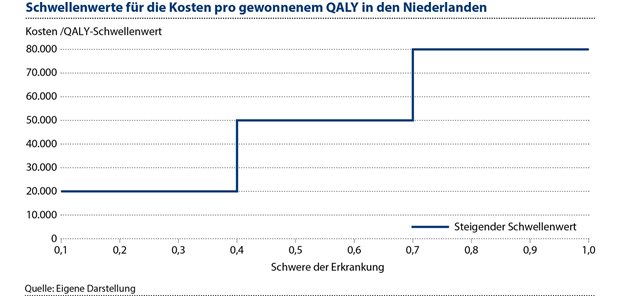
Abbildung 1: Die Kosten einer Intervention pro gewonnenem qualitätsadjustiertem Lebensjahr (QALY) werden mit einem Schwellenwert verglichen, der mit zunehmender Schwere der Erkrankung steigt.
© SMV
Im Rahmen des Lock-Verfahrens müssen die Entwickler neben dem klinischen Dossier ein umfassendes pharmakoökonomisches Dossier einreichen. Das ZIN bewertet dieses Dossier anhand von vier Schlüsselkriterien:
- Notwendigkeit, in erster Linie bestimmt durch die Schwere der Erkrankung, die eine aus öffentlichen Mitteln zu erstattende Behandlung erfordert;
- Relative Wirksamkeit, gemessen am zusätzlichen therapeutischen Nutzen im Vergleich zur bestehenden Standardbehandlung;
- Kostenwirksamkeit, gemessen an den Kosten pro gewonnenes qualitätsadjustiertes Lebensjahr (QALY);
- Durchführbarkeit, die in erster Linie unter finanziellen Gesichtspunkten definiert wird, um sicherzustellen, dass die Auswirkungen auf das Budget erschwinglich sind.
Die „Kosten pro QALY“ einer Intervention werden mit einem Schwellenwert verglichen, der mit zunehmender Schwere der Erkrankung steigt (siehe Abbildung 2)2. Wenn die Kosten pro QALY unter den Schwellenwert fallen, gilt das Arzneimittel als kosteneffektiv.
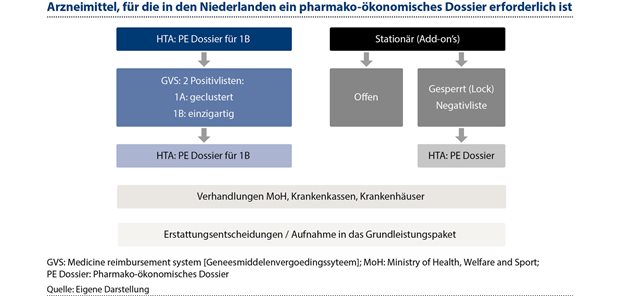
Abbildung 2: Das „Lock-Verfahren“ wurde in den Niederlanden eingeführt, um den Marktzugang für die Erstattung von hochpreisigen Arzneimitteln in Krankenhäusern zu regeln.
© SMV
Je nach Bewertung empfiehlt das ZIN, einen Preisnachlass für das Medikament auszuhandeln, um die Kosteneffizienz zu erhöhen und die Auswirkungen auf das Budget zu verringern. Die Preisverhandlungen werden von einem Team des Gesundheitsministeriums geführt. Im Jahr 2021 konnte das Team einen durchschnittlichen Preisnachlass von 46 Prozent aushandeln, was zu einer Reduzierung der Ausgaben um 745 Millionen Euro führte. Auch wenn dies aus Sicht der Öffentlichkeit erfolgreich zu sein scheint, ist nicht bekannt, inwieweit die Entwickler mit dieser Gewinnspanne gerechnet haben. Wie die Entscheidung des Gesundheitsministers aus dem Jahr 2023, Troveldy® (Sacituzumab Govitecan) und Libmeldy® (Atidarsagen autotemcel) nicht zu erstatten, zeigt, sind die Verhandlungen nicht immer erfolgreich.
Das „Lock-Verfahren“ entstand als Ersatz für ein relativ erfolgloses Experiment mit bedingten Erstattungsvereinbarungen, bei dem nach vier Jahren zusätzlicher Datenerhebung eine Neubewertung erforderlich war.3 In zahlreichen Fällen konnten die gesammelten Daten die Unsicherheit in Bezug auf die Wirksamkeits- und gesundheitsökonomische Evaluationen nicht wesentlich verringern. Obwohl die bedingte Erstattung in den Niederlanden weiterhin eine Option ist, wird sie nur in geringem Umfang genutzt. Darüber hinaus werden ergebnisorientierte Vereinbarungen über den kontrollierten Zugang zu Arzneimitteln aufgrund von Bedenken hinsichtlich der gesellschaftlichen Risikotoleranz, der Durchführbarkeit, des Verwaltungsaufwands, der mit der Ergebnismessung verbundenen Kosten, der Diskussionen über die Entschädigung im Falle einer unzureichenden Wirksamkeit der Behandlung und des Mangels an unterstützenden Einrichtungen für Ärzte zur Überwachung der Ergebnisse nicht in großem Umfang angenommen. Folglich werden in den Niederlanden Vereinbarungen über den kontrollierten Zugang überwiegend in Form von Finanzvereinbarungen getroffen.
Interessant ist auch, dass das ZIN einen neuartigen Bewertungsrahmen eingeführt hat, der auf Tumordiagnostika und von der Europäischen Arzneimittelagentur (EMA) auf der Grundlage einarmiger Studien anerkannte Arzneimittel zugeschnitten ist.4 Je nach Kontext kann das ZIN Folgendes berücksichtigen:
- Evidenz aus einarmigen Basket-Studien, auch wenn diese keine Bewertung der Wirksamkeit pro Tumorlokalisation erlauben;
- Anerkennung möglicher Datenlücken im natürlichen Verlauf oder in der Standardbehandlung von Patienten mit denselben Mutationen, auf die die Tumordiagnostika abzielen, da diese Patienten in der Vergangenheit nicht untersucht wurden;
- Akzeptanz von Zwischenergebnissen wie der objektiven Ansprechrate (Objective response rate, ORR), der Dauer des Ansprechens (Duration of response, DoR), dem krankheitsfreien Überleben (Disease-free survival, DFS) und dem progressionsfreien Überleben (Progression free survival, PFS), sofern die Wahl des Ergebnisses und der minimale wichtige Unterschied (Minimal important difference, MID) in den PICOs während der Scoping-Phase definiert werden und diese Ergebnisse das Gesamtüberleben (Overall survival, OS) vorhersagen können;
- Anerkennung der Notwendigkeit, in gesundheitsökonomischen Modellen einen synthetischen Kontrollarm zu konstruieren.
Diese Überlegungen hängen weitgehend von der Plausibilität der Annahme ab, dass es ohne Behandlung überhaupt kein Ansprechen des Tumors geben wird.
Das ZIN geht schrittweise zu einem risikobasierten und zyklischen HTA-System über5, beginnend mit verlässlichen Methoden zur strategischen Vorausschau (dem sogenannten Horizon-Scanning), um potenziell transformative Gesundheitstechnologien frühzeitig zu erkennen und die damit verbundenen Risiken zu quantifizieren. Anschließend erfolgt eine rasche Risikobewertung, die Unsicherheiten in Bezug auf den therapeutischen Wert, finanzielle Erwägungen und das Potenzial für eine unsachgemäße Anwendung umfasst. Diesen Risiken wird durch umsichtige Risikomanagementstrategien begegnet, die HTA, bedingte Erstattung, kontrollierte Zulassungsprogramme, Preisverhandlungen und Vereinbarungen zur Gewährleistung einer angemessenen Verwendung in der Praxis umfassen.

© privat
Dr. Maureen Rutten-van Mölken ist Professorin für Ökonomische Bewertung von Gesundheitsinnovationen an der Erasmus School of Health Policy & Management, Erasmus Universität Rotterdam, und wissenschaftliche Direktorin des Institute for Medical Technology Assessment (IMTA).
Sie erwarb einen MSc in Gesundheitspolitik und -management und einen PhD in Gesundheitsökonomie an der Universität Maastricht (1994). 1996 kam sie als wissenschaftliche Leiterin zum IMTA und war Assistenzprofessorin für Gesundheitsökonomie und medizinische Technologiebewertung an der Universität Maastricht.
Literatur
- https://go.sn.pub/OMADRo
- https://go.sn.pub/0zFr9n
- https://www.valueinhealthjournal.com/article/S1098-3015(16)30111-5/pdf
- https://www.zorginstituutnederland.nl/binaries/zinl/documenten/publicatie/2023/04/11/beoordeling-swp-2023/Module+Beoordeling+SWP+tumoragnostische+geneesmiddelen.pdf
- https://go.sn.pub/uq4HXI




