Plattform zur Nutzenbewertung – No. 18
Effizienz und Effizienzpotenziale einer künftigen AMNOG-Regulierung
Die Einführung des AMNOG vor über zehn Jahren war mit erheblichen Effizienzgewinnen im Hinblick auf die Preisverhandlungen anhand des nachgewiesenen Zusatznutzens neuer Arzneimittel verbunden. Diese Effekte betreffen insbesondere die allokative Effizienz. Die langfristigen Wirkungen der Regulierung z. B. auf Innovationskraft und Investitionsbereitschaft sind weniger gut bekannt und auch schwerer abzuschätzen. Zukünftig könnte die Weiterentwicklung von Pay-for-Performance-Ansätzen und die Einbeziehung von Kosten-Nutzen-Analysen sowie die Vertraulichkeit von Verhandlungspreisen die Effizienz des AMNOG-Verfahrens erhöhen. Von kostenbasierten Ansätzen zur Preisfindung sind dagegen nach jetzigem Kenntnisstand keine Effizienzverbesserungen zu erwarten.
Veröffentlicht:
© Silvano Rebai / stock.adobe.com
1. Hintergrund
Seit 2011 gilt in Deutschland eine grundsätzlich veränderte Form der Arzneimittelbewertung und -bepreisung, die als AMNOG-Verfahren (Arzneimittelmarktneuordnungsgesetz, AMNOG) bekannt geworden ist. Einer der Hauptzwecke des AMNOG war seinerzeit, ein als überhöht wahrgenommenes Preisniveau von neu auf den Markt kommenden Arzneimitteln zu senken.1 Damals konnten die Preise vom Hersteller relativ frei festgelegt werden. Dies ist im speziellen Fall der Arzneimittel keine effiziente Lösung, da diese im Einzelfall und bei bestehendem Patentschutz als Monopolgut gelten können und zudem in der Regel bis auf kleinere Selbstbeteiligungen vollständig von der Krankenversicherung gezahlt werden. In dieser Konstellation sind im Vergleich zu einem theoretischen Gleichgewichtspreis (also der Annahme gleicher Marktmacht auf Angebots- und Nachfrageseite) überhöhte Preise zu erwarten.

© cacaroot / stock.adobe.com | Springer Medizin Verlag
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Februar 2024 in Heft 18 („AMNOG 2.0: Auf dem Weg zu einem effizienten System“) erschienen.
AMNOG2.0 - Auf dem Weg zu einem effizienten System (4504 kB)
Das AMNOG-Verfahren setzt dieser ineffizienten Marktsituation einen Verhandlungspreis auf der Basis von Wirksamkeitsevidenz entgegen. Auch hier können eine Reihe von Ineffizienzen auftreten, z. B. wenn es sich bei dem neuen Arzneimittel um einen hochwirksamen Solitär handelt, also ein Produkt, das man der betreffenden Patientengruppe mangels wirksamer Behandlungsalternativen aus ethischen Gründen kaum vorenthalten kann. Dies stärkt die Verhandlungsposition des Herstellers, da für diesen immer die Möglichkeit besteht, das Produkt vom deutschen Markt zu nehmen, wenn die herstellerseitigen Preisvorstellungen nicht erfüllt werden. Zwar würde dieses bei dem Unternehmen zu Umsatzeinbußen führen; den Markt zu verlassen, kann aber aus Herstellersicht trotzdem rational sein, da deutsche Preise im Rahmen der internationalen Preisreferenzierung als eine Grundlage für die Preisfindung in anderen Ländern dienen. Ein relativ niedriger Preis in Deutschland hätte somit auch auf anderen internationalen Märkten Einfluss auf den Umsatz des Herstellers.
Über die Jahre ist das AMNOG-Verfahren im Sinne eines „lernenden Systems“ immer wieder angepasst worden, zuletzt im Jahr 2022 mit dem GKV-Finanzstabilisierungsgesetz (GKV-FinStG), das eine Reihe von Maßnahmen beinhaltete, um die Preise bei neuen Arzneimitteln zu begrenzen. Dies ist grundsätzlich nichts Ungewöhnliches: Da sich Märkte und Produktionsverfahren ändern (z. B. in Richtung personalisierter Therapien), muss sich auch die Regulierung von Zeit zu Zeit anpassen. Allerdings sollte zu einer einschneidenden Änderung der gesetzlichen Grundlagen immer auch die Evaluation dieser Reform gehören, die mit angemessenem zeitlichem Abstand und möglichst unabhängig die Wirkung mit den kurz- und langfristigen Zielen, die mit den Reformen verfolgt wurden, abgleicht. Eine Evaluation ist auch im GKV-FinStG vorgesehen, wobei knapp ein Jahr nach Verabschiedung des Gesetzes eine Beurteilung effizienzsteigernder oder potenziell negativer Folgen noch nicht sinnvoll möglich ist.
Im Folgenden sollen einige grundsätzliche Überlegungen zur Frage der Effizienz und Effizienzpotenzialen der AMNOG-Regeln und möglicher Reformoptionen angestellt werden. Dazu sollen zunächst der Begriff der Effizienz näher beleuchtet, Ansätze zu ihrer Messung erläutert und Ansatzpunkte zur Effizienz-Verbesserung diskutiert werden.
2. Zum Begriff der Effizienz
Grundsätzlich wird in der Ökonomik zwischen technischer und allokativer Effizienz unterschieden.2 Daneben findet auch die dynamische Effizienz Anwendung in der wirtschaftswissenschaftlichen Analyse. Die technische Effizienz ist Ausdruck des ökonomischen Prinzips, also der Frage, wie im Optimalfall z. B. eine gegebene Outputmenge zu minimalen Kosten erreicht werden kann. Damit kann beispielsweise das AMNOG-Verfahren selbst gemeint sein, also etwa die Frage, ob die (von außen vorgegebene) Anzahl an neu zu bewertenden Produkten bei gegebener Qualität der Bewertung und Beurteilung mit minimalem Aufwand (z. B. an personellen Ressourcen für Gutachten, zeitlichen Aufwand für Sitzungen etc.) zur vorgegebenen Zeit zum Abschluss gebracht werden kann.
Es könnte sich auch die Frage stellen, ob das AMNOG-Verfahren selbst zur technischen Effizienz der Produktion beiträgt, wie z. B. die Rabattverträge bei Generika, welche in starkem Maße dazu geführt haben, dass weniger leistungsfähige Anbieter mit im Vergleich zu teurer Produktion den Markt verlassen mussten. An dem Beispiel lässt sich auch gut das Prinzip der dynamischen Effizienz verdeutlichen. So muss eine Marktumstrukturierung wie bei den Generikaherstellern mit weitgehenden Produktionsverlagerungen ins außereuropäische Ausland langfristig nicht unbedingt effizient sein, wenn sich hieraus ggf. Lieferschwierigkeiten oder gar politische Abhängigkeiten ergeben. Hier gilt es also, verschiedene Zielvorstellung abzuwägen und in Einklang zu bringen.
Die allokative Effizienz zielt im Kern auf die Frage ab, ob das Angebot den Präferenzen der Nachfrage entspricht oder technisch ausgedrückt, ob die Grenzkosten der Produktion mit den Grenznutzen der Nachfrage übereinstimmen. Ein wichtiges Ziel der AMNOG-Reform war seinerzeit, dass sogenannte Me-Toos, also neu auf den Markt kommende Arzneimittel ohne (gegenüber den schon im jeweiligen Teilmarkt befindlichen Produkten) nachweisbaren Zusatznutzen, keinen höheren Preis als die bisherigen (ggf. sogar generischen) Arzneimittelalternativen erhalten.
Diesen Erwartungen, die „Spreu vom Weizen“ zu trennen, ist das AMNOG-Verfahren umfänglich gerecht geworden und hat insofern die allokative Effizienz, also den Einklang von Grenzkosten des Medikamentes und seinem Grenznutzen für die Patienten, erhöht. Als positiver Nebeneffekt haben die Diskussionen um Daten- und Entscheidungstransparenz sowie die angewandten Methoden der evidenzbasierten Medizin in Deutschland weitreichende Fortschritte gemacht.
3. Messung von Effizienz in Abhängigkeit von den Zielen
Aus den bisherigen Ausführungen ist bereits deutlich geworden, dass es verschiedene Effizienzmaße gibt, die letztlich von den Zielen der Entscheidungsträger abhängen. Dazu könnte auf dem Arzneimittelmarkt gehören, Innovationen im Gesundheitswesen mit nachgewiesenem Zusatznutzen zu fördern und preislich zu belohnen, um weitere Anreize für Innovation und Forschung zu geben (dynamische Effizienz). Die in 2022 eingeführte neue Regulierung mit sogenannten Leitplanken, denen zufolge ein geringer Zusatznutzen gegenüber einer noch im Patent stehenden zweckmäßigen Vergleichstherapie keinen Preisaufschlag rechtfertigt, kann daher kritisch gesehen werden, soweit man auch Schrittinnovationen einen Wert in der Versorgung zubilligt.3
Ein weiteres wichtiges Ziel des AMNOG-Verfahrens war von Anfang an eine stärkere Evidenzbasierung der Entscheidungen, also eine Form der Verwissenschaftlichung des Verfahrens. Die in den letzten Jahren erkennbaren Trends zu früherer Zulassung, weniger gesicherter Evidenz und zunehmend verfügbaren Einmaltherapien, über deren langfristige Wirksamkeit naturgemäß hohe Unsicherheit besteht, erfordern jedoch ein Nachjustieren der bisherigen Bewertungs- und Bepreisungspraxis. Denn für diese Fälle mit hoher Unsicherheit über die Wirksamkeit der Produkte ist das aktuelle AMNOG-Verfahren nicht gut vorbereitet.
Pay-for-Performance-Ansätze könnten in diesen speziellen Bereichen ein Weg sein, den damit verbundenen besonderen Herausforderungen zu begegnen, wobei sich dann wiederum Fragen der Umsetzbarkeit im Sinne technischer Effizienz stellen.4 Entsprechende Leistungsverträge müssten auf kollektiver Ebene geschlossen werden und dort auch administrativ abwickelbar sein. Bislang standen dem häufig eine mangelnde Datenverfügbarkeit oder zu ambitionierte Ergebnisdefinitionen im Wege. Gerade bei langfristigen Verträgen müssten zudem noch Anpassungen im Risikostrukturausgleich zwischen den Krankenkassen erfolgen, damit die Zahlungen nicht nur auf ein Jahr bezogen betrachtet werden können. Entsprechende Vorschläge seitens des Bundesamtes für Soziale Sicherung (BAS) liegen bereits vor und sollten legislativ umgesetzt werden, um die Voraussetzungen für eine stärkere Anwendung von Pay-for-Performance-Verträgen zu verbessern.5
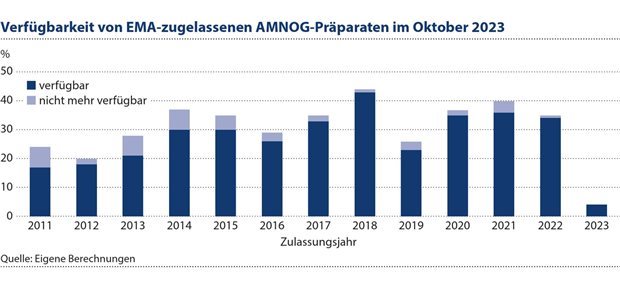
Abbildung 1: Von den im Oktober 2023 von der EMA zugelassenen 394 AMNOG-Präparaten waren 44 – das entspricht 11,2 Prozent – nicht mehr verfügbar.
© Springer Medizin Verlag
Ein weiteres wichtiges Ziel für ein effizientes System früher Nutzenbewertung und -bepreisung ist die frühe Verfügbarkeit von wirksamen, innovativen Arzneimitteln. Als Maß für die Verfügbarkeit käme grundsätzlich der Marktaustritt neu zugelassener Medikamente in Frage wie in Abbildung 1 dargestellt. Demnach waren im Oktober 2023 von den 394 EMA-zugelassenen AMNOG-Präparaten 44 (11,2 Prozent) nicht mehr verfügbar. Diese Kennzahl ist für die Beurteilung der Effizienz aber weitgehend unbrauchbar, denn die Marktabgänge haben sehr unterschiedliche Gründe (z. B. auch Marktverdrängung durch neue, weiter verbesserte Innovationen) und zudem ist die Versorgungsrelevanz darin nicht abgebildet, sodass nicht klar wird, in welchem Umfang ein Marktaustritt einzelner Produkte nicht zumindest teilweise durch andere substituiert werden kann. Solitäre ohne annähernd gleich wirksame Alternative sind somit mit höheren Nutzeneinbußen bei den Patienten verbunden als stärker austauschbare Produkte.
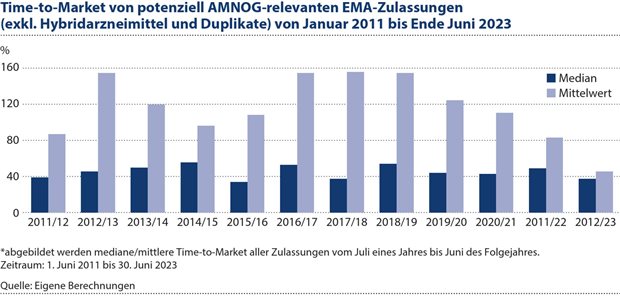
Abbildung 2: Die Zeitspanne von der Zulassung eines Arzneimittels bis zu dessen Markteintritt liegt seit Jahren konstant bei 40 bis 50 Tagen.
© Springer Medizin Verlag
Anders stellt sich die Kennzahl Time-to-Market dar, also die Zeitspanne von der Zulassung eines Arzneimittels bis zu dessen Markteintritt. Gemäß Abbildung 2 liegt der Median sehr konstant über die Jahre bei etwa 40 bis 50 Tagen. Dabei handelt es sich um einen vergleichsweise sehr kurzen Zeitraum, den nur wenige Länder auf der Welt erreichen. Diese Kennzahl variiert zwar erheblich, wie am Mittelwert der Time-to-Markt der EMA-zugelassenen AMNOG-Präparate von 119 Tagen deutlich wird, aber insgesamt lässt sich feststellen, dass das AMNOG-Verfahren den Markteintritt offenbar nicht verzögert hat. Dazu hat sicher die freie Preissetzung durch den Hersteller in den ersten sechs Monaten beigetragen. Die Reduktion in dieser Frist von früher zwölf auf jetzt sechs Monate im Zuge des GKV-FinStG kann demgegenüber ebenfalls zur allokativen Effizienz (hier zur Vermeidung überhöhter Preise) beigetragen haben. An diesem Sachverhalt wird deutlich, dass auch allseits akzeptierte Ziele (hier die frühe Verfügbarkeit einerseits und das zügige Gelten niedrigerer Verhandlungskreise andererseits) häufig in Konkurrenz zueinanderstehen.
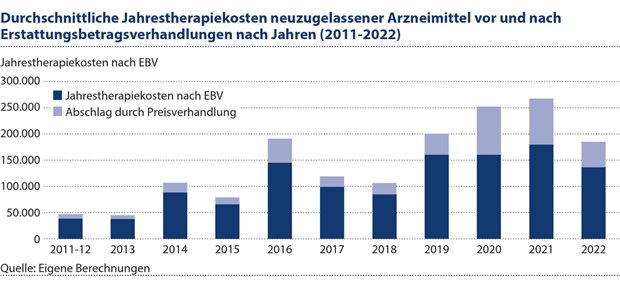
Abbildung 3: Der Vergleich der Jahrestherapiekosten neu zugelassener Arzneimittel vor und nach Erstattungsbetragsverhandlungen macht die Einspareffekte in Folge des AMNOG-Verfahrens deutlich.
© Springer Medizin Verlag
Schließlich sei noch als ein übergreifendes Ziel der AMNOG-Einführung im Jahr 2011 genannt, dass die neue Regierung auch zur finanziellen Stabilität in der Krankenversicherung beitragen sollte. Dass dieses Ziel zumindest im Grundsatz erreicht wurde, zeigt Abbildung 3, welche die Jahrestherapiekosten neu zugelassener Arzneimittel vor und nach Erstattungsbetragsverhandlungen abbildet. Daraus sind substanzielle Einspareffekte erkennbar, die allerdings noch keine Rückschlüsse auf an externe Zielgrößen wie die volkswirtschaftliche Produktivität sowie die Auswirkungen der Regulierung auf Investitionen und den Studienstandort in Deutschland zulassen.
Eine umfassende Evaluation müsste auch die genannten externen Effekte des AMNOG-Verfahrens auf diese Kenngröße bewerten, um die Effizienz des Verfahrens umfassend beurteilen zu können. Dazu sind allerdings weitreichende Annahmen zu treffen, welche die Evaluationsergebnisse angreifbar machen könnten. Gleichwohl wären entsprechende Abschätzungen für eine Gesamtbeurteilung von Reformmaßnahmen sehr wertvoll und könnten beispielsweise in Szenarien mit vollständiger Offenlegung der verwendeten Annahmen und der mit ihnen verbundenen Unsicherheit erfolgen.
4. Effizienzpotenziale
Im vorigen Abschnitt war schon angesprochen worden, dass aufgrund von Veränderungen des Marktumfeldes Nachjustierungen bestehender Regulierungen geboten sein können, um die Effizienz des Verfahrens zu erhalten. Das gilt beispielsweise für ein stärkeres Gewicht von sogenannten Pay-for-Performance-Verträgen bei der Bepreisung einiger neuer Arzneimittel, um ggf. der höheren Unsicherheit bei der Evidenzgenerierung zu entsprechen. Daten zur Wirksamkeit könnten dann nicht wie bisher nur vergangenheitsbezogen erhoben und für die Preisfindung genutzt werden.
Kostenbasierte Ansätze zur Bemessung eines angemessenen Preises für innovative Arzneimittel sind dagegen in der Regel wenig effizient, weil die dazu notwendige Umlage von Gemeinkosten auf einzelne Produkte bei pharmazeutischen Unternehmen kaum lösbare Probleme aufwirft.6 Wie sollten beispielsweise die Kosten gescheiterter Forschungsprojekte eines Unternehmens zutreffend auf die erfolgreichen Produkte verteilt werden?
Einfache Pauschalen zur Berücksichtigung von Forschungsaufwendungen und Gewinn sind methodisch nicht geeignet, weil sie der individuellen betrieblichen und projektbezogen Situation kaum hinreichend entsprechen können. Zudem widersprechen kostenbasierte Preisfindungsansätze auch dem Ziel technischer Effizienz, denn sie bieten keinen Anreiz zu einer ressourcenschonenden Forschung, wenn alle entstehenden Kosten, unabhängig vom Patientennutzen, anschließend auf den Preis umgelegt werden könnten.
Eine effizienzsteigernde Alternative zur Weiterentwicklung des AMNOG wäre dagegen, optional auch Kosten-Nutzen-Analysen in das Bewertungsverfahren einzubeziehen.7 Im Rahmen der Bewertung neuer Impfstoffe durch das Robert Koch-Institut (RKI) bzw. die dortige Ständige Impfkommission (STIKO) sind Kosten-Nutzen-Analysen bereits gängige Praxis. Und auch in Nachbarländern wie Frankreich, den Niederlanden und Dänemark sind bislang keine der in Deutschland befürchteten Konsequenzen, wie z. B. eine Diskriminierung in der Versorgung vulnerabler Gruppen, eingetroffen.
Dies war auch nicht zu erwarten, denn die systematische Gegenüberstellung von Kosten und Nutzen im Rahmen des Bewertungsverfahrens schafft bessere Voraussetzung für rationale Entscheidungen und kann dabei gesellschaftlich unabdingbare Nebenbedingungen wie die besondere Förderung von Therapien bei seltenen Erkrankungen sehr transparent abbilden. Die dafür notwendigen Daten und Modelle sind in der Regel schon allein deswegen bereits vorhanden, weil alle größeren europäischen Staaten seit Jahren Kosten-Nutzen-Analysen ergänzend zur Preisfindung verwenden. Diese wären in der Grundstruktur meist relativ einfach auf Deutschland adaptierbar.
Die hohe Transparenz der Verhandlungskreise bei neuen Arzneimitteln ist ebenfalls ein Spezifikum des deutschen Gesundheitswesens, das in dieser Konsequenz kein anderes vergleichbares Land aufweist. Zwar ist auf vollkommenen Märkten eine totale Preistransparenz eine wichtige Voraussetzung für eine optimale und damit effiziente Allokation, allerdings ist der Arzneimittelpatentmarkt schon von der Idee her kein vollkommener Markt, sondern zeichnet sich bewusst durch ein für die Dauer des Patentes zeitlich befristetes Monopol aus. Das gilt zumindest, solange keine anderen konkurrierenden Produkte mit ähnlicher oder sogar höherer Wirksamkeit in den Markt eintreten. Zudem könnten vertrauliche Preise einzelwirtschaftlich, also z. B. aus Sicht der Gesetzlichen Krankenversicherung (aber auch der pharmazeutischen Unternehmen), durchaus effizient sein. Gerade angesichts Internationaler Preisreferenzierungen sind niedrigere Preisofferten seitens der Hersteller zu erwarten, wenn diese nicht mehr befürchten müssen, dass ihre Angebote anschließend in einem anderen Land als Ausgangspunkt für Verhandlungen zu noch niedrigeren Preisen genutzt werden.
Genau deshalb ist international die Vertraulichkeit von verhandelten Arzneimittelpreisen die Regel, die deutsche Transparenz darüber dagegen die Ausnahme. Die gegen eine Vertraulichkeit vorgebrachten Argumente sind in der Regel eher technischer Natur, z. B. eine erschwerte Abrechnung über die Handelsstufen, welche aber bei den Rabattverträgen8 für Generika in ähnlicher Weise auftreten und offensichtlich kein unlösbares Problem darstellen.
5. Fazit
Die Einführung des AMNOG vor über zehn Jahren war ein Effizienzsprung aus einer Welt von monopolähnlichen Preisen in ein regel- und evidenzbasiertes System, das einen Ausgleich zwischen den Ertragsinteressen des Herstellers und den Interessen des Versorgungssystems nach medizinischem Fortschritt und der Bezahlbarkeit des Systems sucht. Es ist alles in allem den Ansprüchen an Effizienz und Fairness gerecht geworden, wobei neben der statischen Effizienz (z. B. von heutigen Einsparerfolgen) auch die langfristigen Regulierungswirkungen (z. B. auf Innovationskraft und Investitionsbereitschaft) beachtet werden sollten. Eine Verfeinerung der Regulierung kann im Zeitablauf notwendig sein, wenn Ausweichreaktionen der Marktteilnehmer sichtbar werden oder das Marktumfeld sich ändert. Solche Regulierungsänderungen können aber potenziell auch zu erheblichen Transaktionskosten in der Durchführung führen, die den angedachten Effizienzvorteil wieder egalisieren.3 Dies sollte daher nach Reformen ausreichend evaluiert werden. Zukünftig könnte die Weiterentwicklung von Pay-for-Performance-Ansätzen und die Einbeziehung von Kosten-Nutzen-Analysen sowie die Vertraulichkeit von Verhandlungspreisen die Effizienz des AMNOG-Verfahrens erhöhen. Von kostenbasierten Ansätzen zur Preisfindung bei Arzneimitteln sind dagegen nach jetzigem Kenntnisstand keine Effizienzverbesserungen zu erwarten.

© Universität Bielefeld
Prof. Dr. Wolfgang Greiner ist Inhaber des Lehrstuhls für „Gesundheitsökonomie und Gesundheitsmanagement“ an der Universität Bielefeld.
Von 2010 bis 2023 war er Mitglied im Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen beim Bundesgesundheitsministerium.
Er gehört zudem den wissenschaftlichen Beiräten verschiedener Krankenkassen und des Bundesamtes für Soziale Sicherung für die Weiterentwicklung des Risikostrukturausgleiches an.

© Vitali Brikmann
Dr. Daniel Gensorowsky ist Leiter Gesundheitsökonomie der Vandage GmbH, einer auf die Generierung von Real-World-Evidence, gesundheitsökonomische Evaluation, Pharmakoökonomie und Statistik spezialisierten Boutique-Beratung.
Zuvor war er wissenschaftlicher Mitarbeiter am Lehrstuhl für Gesundheitsökonomie und Gesundheitsmanagement der Universität Bielefeld, wo er zum Marktzugang und zur Evaluation digitaler Gesundheitstechnologien promoviert hat.
Dr. Gensorowsky ist Co-Autor des regelmäßig erscheinenden AMNOG-Reports der DAK-Gesundheit.

© Vitali Brikmann
Dr. Julian Witte ist Gründer und Geschäftsführer der Vandage GmbH, einer auf die Generierung von Real-World-Evidence, gesundheitsökonomische Evaluation, Pharmakoökonomie und Statistik spezialisierten Boutique-Beratung.
Zuvor war er wissenschaftlicher Mitarbeiter am Lehrstuhl für Gesundheitsökonomie und Gesundheitsmanagement der Universität Bielefeld und hat zur Preisbildung neuer Arzneimittel promoviert.
Dr. Witte ist Co-Autor des regelmäßig erscheinenden AMNOG-Reports der DAK-Gesundheit.
Literatur
- Ludwig WD (2020): Zehn Jahre AMNOG – Rückblick und Ausblick aus Sicht der Arzneimittelkommission der deutschen Ärzteschaft. Schwabe U Ludwig WD (Hrsg.) Arzneimittelverordnungs-Report 2020: 185-200.
- Störmann W (2019): Gesundheits- und Umweltökonomik klipp & klar. Springer Gabler.
- Greiner W Witte J Gensorowsky D Diekmannshemke J (2023): AMNOG-Kurzreport 2023 – Evaluation von Maßnahmen aus dem GKV-Finanzstabilisierungsgesetz – Status quo. Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 45) medhochzwei-Verlag.
- Dabbous M Chachoua L Caban A Toumi M (2020): Managed Entry Agreements: Policy Analysis From the European Perspective. Value in Health 23(4): 425-433.
- Bundesamt für Soziale Sicherung (2022), Sondergutachten zu den Wirkungen von Pay-for-Performance-Verträgen vor dem Hintergrund des Risikopools. Abrufbar über https://go.sn.pub/Mve5cM
- Hollis A (2016): Sustainable Financing of Innovative Therapies – A Review of Approaches. PharmacoEconomics 34:971-980.
- Ochalek J Revill P Drummond M (2020): Allocating Scarce Resources - Tools for Priority Setting. Revill P Suhrcke M Moreno-Serra R Sculpher M (Hrsg): Global Health Economics Shaping Health Policy in Low-and Middle-Income Countries: 53-74.
- Bauckmann J Laitenberger U Schröder M Telschow C (2017): Rabattverträge. Schwabe U Paffrath D Ludwig WD Klauber J (Hrsg.) Arzneimittelverordnungs-Report 2017: 181-194.




