Zusammenspiel von HTA und Zulassung
Koexistenz von EU-HTA und AMNOG-Verfahren: die Perspektive der KBV
Um eine Diskrepanz zwischen dem EU-HTA- und dem AMNOG-Verfahren zu vermeiden, sollten sich zusätzliche nationale Auswertungen auf ein Minimum beschränken. Ein umfangreiches „Delta-Dossier“ stünde im Widerspruch zum Zweck des EU-HTA-Verfahrens.
Veröffentlicht:
Mit der EU-HTA-Verordnung sollen ab dem 12. Januar 2025 zunächst für Arzneimittel mit neuen Wirkstoffen zur Behandlung von onkologischen Erkrankungen und ATMP (Advanced Therapy Medicinal Products) eine gemeinsame klinische Bewertung (JCA) vorgenommen werden.
© Weissblick / stock.adobe.com
Leitplanken für Erstattungsbetragsverhandlungen
Auch wenn die Ärzteschaft von den neuen Leitplanken für Erstattungsbetragsverhandlungen in Paragraf 130b Absatz 3 SGB V nicht direkt betroffen ist, erscheint der Hinweis auf möglicherweise nicht beabsichtigte Kollateralschäden mit negativen Auswirkungen auf die Verfügbarkeit von Arzneimittelinnovationen notwendig.
Wenn der G-BA im Rahmen der Nutzenbewertung für ein Arzneimittel einen nicht quantifizierbaren Zusatznutzen oder einen geringen Zusatznutzen festgestellt hat und als zweckmäßige Vergleichstherapie (zVT) ein Arzneimittel bestimmt wurde, für das Patentschutz oder Unterlagenschutz besteht, ist nunmehr ein Erstattungsbetrag zu vereinbaren, der nicht zu höheren Jahrestherapiekosten führt als die zVT.
Damit wurde ein bisher etablierter Grundsatz des AMNOG-Verfahrens außer Kraft gesetzt, nachdem ein pharmazeutischer Unternehmer (pU) mit einem Wirkstoff oder einer Wirkstoffkombination und nachgewiesenen patientenrelevanten Vorteilen, einen Preisaufschlag in Bezug auf die zVT beanspruchen konnte, der unter Berücksichtigung des erreichten Zusatznutzens frei verhandelt wurde.
In der Arzneimittel-Nutzenbewertungsverordnung (AM-NutzenV) wurden deshalb in Paragraf 5 Absatz 7 bereits im Rahmen der ursprünglichen Ausgestaltung des AMNOG-Verfahrens differenzierte Mindestvoraussetzungen der Effektgrößen für die einzelnen Nutzenkategorien festgelegt: Ein geringer Zusatznutzen liegt erst vor, wenn „eine gegenüber der zVT bisher nicht erreichte, moderate und nicht nur geringfügige Verbesserung“ erreicht wird. Diese Mindestvoraussetzungen lassen sich ebenfalls im IQWiG-Methodenpapier finden, in dem Schwellenwerte für die einzelnen Nutzenkategorien auf Endpunktebene definiert wurden.1

© Cagkan / stock.adobe.com
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Monat Jahr in Heft 19 („Zusammenspiel von HTA und Zulassung“) erschienen.
Ein nicht quantifizierbarer Zusatznutzen ist mindestens ein geringer Zusatznutzen, umfasst allerdings auch die Nutzenkategorien beträchtlich und erheblich. Auf Basis der vorliegenden Evidenz ist alleinig die Kategorisierung des Zusatznutzens, der jedoch grundsätzlich nicht infrage gestellt wird, unklar. Es fand mit dem GKV-FinStG somit eine Entwertung von Arzneimittelinnovationen mit geringem oder nicht quantifizierbarem medizinischen Zusatznutzen statt.
Schwerwiegend könnten die Folgen in Härtefallkonstellationen sein, in denen ein Wirkstoff A mit Patentschutz oder Unterlagenschutz in Kombination mit einem weiteren Wirkstoff B ohne Schutzrechte neu zugelassen wird und der Wirkstoff A gleichzeitig als zVT bestimmt wurde. Selbst wenn der G-BA einen Hinweis auf einen geringen Zusatznutzen (eine randomisierte kontrollierte Studie mit hoher Ergebnissicherheit liegt vor) feststellt, muss eine Preisreduktion um die Kosten des Kombinationspartners B durchgesetzt werden, um den gesetzlichen Anforderungen für die Erstattungsbetragsverhandlungen zu genügen.
Wenn die Zulassung für einen Wirkstoff A mit Patentschutz oder Unterlagenschutz erfolgt, der mit einem weiteren Wirkstoff C mit Patentschutz oder Unterlagenschutz kombiniert wird, wobei Wirkstoff C gleichzeitig die zVT darstellt, müsste bei einem Hinweis auf einen geringen Zusatznutzen der neue Wirkstoff A dem GKV-System kostenfrei zur Verfügung gestellt werden.
Da zusätzlich der Kombinationsabschlag nach Paragraf 130e SGB V in Höhe von 20 Prozent des Abgabepreises zu entrichten ist, könnte die Kombination insgesamt geringere Kosten verursachen als die Monotherapie mit schlechter Wirkung auf patientenrelevante Endpunkte. Die Anwendung des neuen Wirkstoffes A in Deutschland müsste durch den pU subventioniert werden. Eine Marktrücknahme seitens des pU in den beschriebenen Konstellationen ist zu erwarten.
Update zum EU-HTA-Verfahren
Die EU-HTA-Verordnung (Regulation (EU) 2021/2282) trat am 11. Januar 2022 in Kraft. Ein schrittweiser Beginn ist vorgesehen. Zunächst sollen ab dem 12. Januar 2025 für Arzneimittel mit neuen Wirkstoffen zur Behandlung von onkologischen Erkrankungen und ATMPs (Advanced Therapy Medicinal Products), für die ab diesem Zeitpunkt ein Zulassungsantrag bei der Europäischen Arzneimittel-Agentur (EMA) gestellt wird, eine gemeinsame klinische Bewertung (JCA) vorgenommen werden. Orphan Drugs können hiervon ebenfalls schon umfasst sein, obwohl eine generelle Bewertung von Orphan Drugs erst ab dem 13. Januar 2028 vorgesehen ist.
Für Deutschland wurden Vertreter des Gesundheitsministeriums, des G-BA und des IQWiG als Mitglied der Koordinierungsgruppe (KG) benannt. Zudem hat der G-BA den Vorsitz der Subgruppe für gemeinsame wissenschaftliche Beratungen (Subgruppe JSC) übernommen. In den anderen drei Subgruppen der KG ist der G-BA ebenfalls vertreten. Um diese Mitwirkung und auch eine zukünftige Assessorentätigkeit auf eine solide gesetzliche Basis zu stellen, sollte zeitnah eine Rechtsgrundlage im SGB V zur Einbindung des G-BA in die Strukturen und Prozesse des EU-HTA-Verfahrens geschaffen werden.
Obwohl nur noch wenige Monate bis zum Beginn der ersten JCAs verbleiben, ergibt sich für die nationale Implementierung, speziell für das Schnittstellenmanagement zwischen EU-HTA-Verfahren und AMNOG-System, ein längeres Zeitfenster, da mit der Zulassung der ersten Wirkstoffkandidaten und einem Inverkehrbringen in Deutschland erst ab dem Jahr 2026 zu rechnen ist.
Mit Bezug auf eine Antwort der Bundesregierung auf eine Kleine Anfrage der CDU/CSU-Bundestagsfraktion ist davon auszugehen, dass wesentliche Teile des etablierten und bewährten AMNOG-Prozesses bestehen bleiben.2 Ändern wird sich allerdings die Zusammensetzung des Evidenzkörpers, auf dem die Nutzenbewertung nach Paragraf 35a SGB V zukünftig aufbauen wird. Anstatt eines Volldossiers, bestehend aus umfangreichen Datenlieferungen in fünf Modulen, wird zukünftig der EU-HTA-Bericht zu berücksichtigen sein. Dieser Bericht darf laut Artikel 9 Absatz 1 der EU-HTA-Verordnung keine Werturteile oder Schlussfolgerungen zum gesamten klinischen Zusatznutzen enthalten und soll eine aggregierte Darstellung der von den einzelnen Mitgliedstaaten geforderten Outcome-Parameter zu jedem PICO-Schema beinhalten.3
Das deutsche PICO-Schema wird als solches im EU-HTA-Bericht nicht erkenntlich sein und könnte sich im Falle von gebildeten Teilpopulationen auch auf mehrere PICO-Schemata im konsolidierten Bewertungsumfang verteilen. Der EU-HTA-Bericht kann somit als ein umfangreiches technisches und wertungsfreies Vorprodukt angesehen werden, welches einer zusätzlichen Bearbeitung bedarf und per se ungeeignet für eine Stellungnahme oder eine Diskussion in den Gremien des G-BA ist. Hierzu wird eine Beauftragung des IQWiG befürwortet, insbesondere um die für den nationalen Kontext bewertungsrelevanten Daten zu extrahieren. Für Orphan Drugs könnte die Fachberatung Medizin der Geschäftsstelle des G-BA diese Aufgabe in Analogie zum bisherigen Vorgehen übernehmen.
Laut EU-HTA-Verordnung können die Mitgliedstaaten ergänzende klinische Analysen durchführen, wenn diese für den nationalen HTA-Prozess erforderlich sind. Diese ergänzenden Analysen sowie weitere für das AMNOG-Verfahren notwendige Informationen (Patientenzahlen und Therapiekosten) bilden die Basis für ein „Delta-Dossier“, welches neben dem EU-HTA-Bericht zukünftig Bestandteil des Evidenzkörpers für eine Nutzenbewertung nach Implementierung des EU-HTA-Verfahrens sein wird. Darauf aufbauend kann dann durch das IQWiG in einem zusammenfassenden Bericht ein Vorschlag zum Ausmaß und zur Wahrscheinlichkeit des Zusatznutzens erfolgen, der dann die Grundlage für ein Stellungnahmeverfahren und die weiteren Beratungen im G-BA bildet.
Inhalt und Umfang eines „Delta-Dossiers“ werden aktuell diskutiert, können allerdings erst nach der Veröffentlichung der methodischen und verfahrenstechnischen Guidelines abschließend definiert und festgelegt werden.
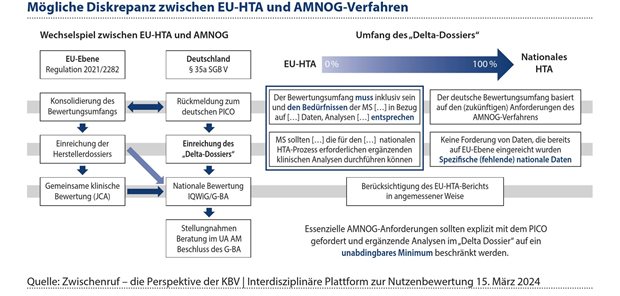
Abbildung 1: Je mehr ergänzende Analysen von den Mitgliedsstaaten im Zuge ihrer nationalen HTA-Prozesse gefordert werden, desto mehr entfernt man sich vom Gedanken einer gemeinsamen klinischen Bewertung.
© Springer Medizin Verlag
Die ergänzenden Nachforderungen sollten sich dabei allerdings auf ein unabdingbares Minimum beschränken, um eine Diskrepanz zwischen EU-HTA-Verfahren und nationalem Verfahren zu vermeiden. Je mehr ergänzende Analysen mit dem „Delta-Dossiers“ gefordert werden, umso weiter entfernt man sich vom Gedanken einer gemeinsamen klinischen Bewertung und erzeugt einen Widerspruch zum Zweck der EU-HTA-Verordnung, insbesondere dann, wenn zu großen Teilen der Studiendaten regelhaft ergänzende Analysen durchgeführt werden (siehe Abbildung 1).
Laut Artikel 8 Absatz 6 der EU-HTA-Verordnung muss der Bewertungsumfang des Verfahrens inklusiv sein und den Bedürfnissen der Mitgliedstaaten in Bezug auf die vom pU vorzulegenden Informationen, Daten und Analysen entsprechen. In der Practical Guideline zum Scoping-Process wird dazu konkretisiert, dass es in der Verantwortung der Mitgliedstaaten liege, dies mit ihrem jeweiligen PICO sicherzustellen, welches entsprechend den nationalen Rechts- und Verfahrensvorschriften festzulegen sei.3
Wenn der G-BA den EU-HTA-Bericht nicht verwenden kann, wurde das PICO somit falsch oder nicht ausreichend präzise festgelegt. Essenzielle Bestandteile der AMNOG-Anforderungen, insbesondere der zugrundeliegenden Methodik, müssten somit explizit im PICO gefordert werden, wenn die entsprechende Guideline diese Möglichkeit eröffnet oder zumindest nicht ausschließt. Als Beispiel sei hier exemplarisch die vom IQWiG vorgeschlagene und vom G-BA akzeptierte 15-Prozent-Schwelle für die Anerkennung von Responder-Analysen genannt.4 Um die Zahl der zu bearbeitenden PICOs und Outcome-Parameter zu verringern, ist bei der PICO-Konsolidierung ein Austausch zwischen den Assessoren und den jeweiligen Mitgliedsstaaten vorgesehen. Die Festlegung des Bewertungsumfanges wird zurzeit im Rahmen von Übungsverfahren (Mock PICOs) erprobt und verfeinert.
Entwurf der Durchführungsverordnung zum EU-HTA-Verfahren
Der Entwurf der Durchführungsverordnung zum EU-HTA-Verfahren wurde am 5. März 2024 auf den Internetseiten der EU-Kommission veröffentlicht und konnte bis zum 2. April 2024 öffentlich kommentiert werden.5Folgende Sachverhalte wurden dabei von der KBV kritisch angemerkt:
Selbst unter der Annahme, dass die Anzahl der zu bearbeitenden PICOs im Rahmen des Konsolidierungsprozesses reduziert werden kann, erscheint eine Frist von 90 Tagen (nur 60 Tage bei einem beschleunigten Verfahren) für die Erstellung eines EU-Dossiers durch den pU als zu knapp bemessen.
Es ist zu begrüßen, dass aktuelle Daten aus klinischen Studien während eines laufenden JCA nachgereicht und berücksichtigt werden können. Auf Basis der bestehenden Fristen und hohen Anzahl notwendiger Analysen wird die praktische Umsetzbarkeit dieser Option jedoch angezweifelt.
Der EU-HTA-Bericht beinhaltet die wissenschaftliche Analyse und Darstellung von aggregierten Daten aus dem Dossier des pU, unter Berücksichtigung der konkreten Bedürfnisse der einzelnen Mitgliedsstaaten. Es ist nicht nachvollziehbar, dass der EU-HTA-Bericht vertrauliche Daten enthalten kann. Er sollte deshalb aus Gründen der Transparenz vollständig veröffentlicht werden.

© Matthias Friel/KBV
Dr. Florian Jantschak
Apotheker, Studium der Pharmazie an der FU Berlin (10/2002-03/2007), Approbation als Apotheker (01/2008), Doktorand am Institut für Pharmazie der FU Berlin (03/2008- 03/2012), Promotion (06/2013). Filialleitung einer öffentlichen Apotheke (06/2012-02/2013), Referent in der Abteilung Arzneimittel des G-BA (09/2013-08/2018), Senior Referent in der Abteilung Arzneimittel bei der Kassenärztlichen Bundesvereinigung (seit 09/2018). Schwerpunkte: AMNOG-Verfahren, Onkologie, anwendungsbegleitende Datenerhebungen, EU-HTA).
Literatur
1 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023). Allgemeine Methoden Version 7.0. https://go.sn.pub/mkwigq
2 Antwort der Bundesregierung auf die Kleine Anfrage der Fraktion der CDU/CSU – Drucksache 20/6665 – Nationale Implementierung des europäischen Nutzenbewertungsprozesses von Gesundheitstechnologien, Drucksache 20/6930. (22. Mai 2023). https://go.sn.pub/0cyt81
3 EUnetHTA 21 (2023). Practical Guideline D4.2 Scoping Process Version 1.1. https://go.sn.pub/a4zemy
4 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. „Klinische Relevanz patientenberichteter Endpunkte: Neuer Schwellenwert erweist sich als praxistauglich.“ (Pressemitteilung vom 18. Februar 2021). https://go.sn.pub/jmstw4
5 Draft implementing regulation laying down procedural rules for the preparation of joint clinical assessments of medicinal products for human use, Ares (2024)1703728. (5. März 2024).
Ein überprüfender Zugriff auf die Internetquellen erfolgte am 8. April 2024.