Zusammenspiel von HTA und Zulassung
Nutzen- und Risikobewertung neuer Arzneimittel: Die Sicht des BfArM
Die Pharmastrategie hat das Ziel, Deutschland als F & E-Standort attraktiver zu machen. Zugleich sollen das Digital- und das Gesundheitsdatennutzungsgesetz eine bessere Gesundheits- und Pflegeversorgung unterstützen. Das BfArM versteht sich als „Enabler“ und Partner in diesem Prozess.
Veröffentlicht:
Dem BfArM kommen zentrale Aufgaben bei der Vereinfachung und Beschleunigung von klinischen Prüfungen und Genehmigungsprozessen, weiteren Entbürokratisierungsmaßnahmen sowie bei der zukünftigen Nutzung stetig wachsender Mengen von Gesundheitsdaten zu.
© Soeren Stache / ZB / picture-alliance
Die Arzneimittelentwicklung und medizinische Technologie erleben eine zunehmend rasante Dynamik, angetrieben durch Fortschritte in der Wissenschaft und Technik, vor allem auch der zunehmenden Digitalisierung. Diese Fortschritte führen zu schnelleren Entwicklungszyklen von Arzneimitteln und ermöglichen die Einführung innovativer Behandlungsmethoden in einem wachsenden digitalen Ökosystem Gesundheit. Deutschland nimmt eine herausragende Rolle in der Arzneimittelforschung und -entwicklung ein.
Dies hat sich nicht nur während der COVID-Pandemie gezeigt; hier konnten in Rekordzeit der erste COVID-Impfstoff und -Test entwickelt werden. Neben Spanien werden die meisten multizentrischen klinischen Studien in Europa in Deutschland durchgeführt,1 was die exponierte Position Deutschlands als ein bedeutender Standort für die Entwicklung und Herstellung von Arzneimitteln untermauert (siehe Abbildung 1).

© Cagkan / stock.adobe.com
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Monat Jahr in Heft 19 („Zusammenspiel von HTA und Zulassung“) erschienen.
Die schnelleren Entwicklungszyklen von Arzneimitteln erfordern eine enge Zusammenarbeit zwischen Forschungsinstituten, Unternehmen und Behörden. Deutschland bietet ein ideales Umfeld für diese Zusammenarbeit, da es grundsätzlich über eine gut etablierte Infrastruktur verfügt, die es ermöglicht, Forschungsergebnisse schnell in marktfähige Produkte umzusetzen. Und auch im Bereich der Digitalisierung im Gesundheitswesen hat Deutschland in den letzten Jahren, unter anderem durch das Digitale-Versorgung-Gesetz, bereits deutlich gegenüber anderen Ländern aufgeholt.
Gleichzeitig zeigen aber Analysen, dass unter anderem als Folge des Brexits, der Pandemie u.a. aktueller Krisen der Standortwettbewerb auch im Gesundheitsbereich deutlich angezogen und Deutschland als Forschungs- vor allem aber als Entwicklungsstandort an Attraktivität verloren habe.2 Die Pandemie hat die Vulnerabilitäten von Lieferketten u. a. aufgrund einer Konzentration auf wenige Herstellungsstätten in Drittstaaten deutlich freigelegt. Auf regulatorischer Seite haben die „Lessons Learned“ aus der Pandemie deutlich aufgezeigt, wo Vereinfachungen in Genehmigungs- und Bewertungsverfahren möglich sind. Als nationale Herausforderungen für den Innovationsstandort Deutschland wurden zudem Erschwernisse bei der Organisation von klinischen Studien, beim Zugang zu Gesundheitsdaten und im Bereich von Kooperationen mit der akademischen Forschung identifiziert.2
Um auch perspektivisch für eine umfassende, moderne Gesundheitsversorgung gut aufgestellt zu sein und die Attraktivität des Pharmastandorts Deutschland zukunftsfähig auszubauen, sind eine Reihe an Modernisierungs- und Reformvorhaben auf nationaler, wie auch auf europäischer Ebene auf den Weg gebracht worden und sind integrale Bestandteile der Pharma- und Digitalisierungsstrategie des Bundes.3,4 Dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) kommt hier, zusammen mit dem Paul-Ehrlich-Institut (PEI), eine zentrale Rolle in der Implementierung und Umsetzung zentraler Vorhaben zu.
Stärkung des Forschungs- und Entwicklungsstandortes Deutschland für eine zukunftsweisende Gesundheitsversorgung: Von der Pharmastrategie zu Medizinforschungsgesetz, Digitalgesetz und Gesundheitsdatennutzungsgesetz
Die Pharmastrategie Deutschlands ist ein umfassender Plan, der darauf abzielt, Deutschland als Wissenschafts- und Forschungsstandort zu stärken, die Innovationsfähigkeit zu fördern und somit den Patientinnen und Patienten auch in Zukunft einen umfassenden Zugang zu sicheren und wirksamen Arzneimitteln und weiteren innovativen Therapieoptionen zu gewährleisten. Die Strategie umfasst verschiedene Maßnahmen, darunter die Förderung und Erleichterung von Forschung und Entwicklung, die Unterstützung von Start-ups und (kleinen) Unternehmen, die Verbesserung der Zusammenarbeit zwischen Industrie, Forschung und Regierung, die Förderung der Digitalisierung des Gesundheitswesens sowie die Modernisierung und Entbürokratisierung von regulatorischen Prozessen.
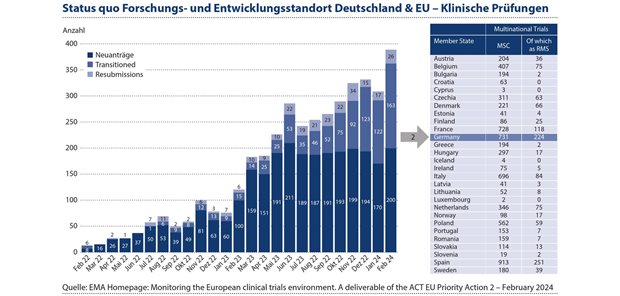
Abbildung 1: Deutschland nimmt eine herausragende Rolle in der Arzneimittelforschung und -entwicklung ein. Neben Spanien werden die meisten multizentrischen klinischen Studien in Europa in Deutschland durchgeführt.
© Springer Medizin Verlag
Der Entwurf für ein Medizinforschungsgesetz (MFG)5 ist ein zentraler Teil dieser Strategie mit Blick auf das Ziel, die medizinische Forschung in Deutschland zu stärken. Dazu wird es insbesondere den rechtlichen Rahmen für die Durchführung von klinischen Studien verbessern, bürokratische Prozesse und Genehmigungsverfahren bei klinischen Studien und Zulassungsprogrammen vereinfachen und den Zugang zu Forschungsdaten erleichtern. Die folgende Übersicht gibt einen Überblick über die zentralen Maßnahmen des MFG (siehe Abbildung 2).
Erleichterungen bei der Planung und Durchführung von klinischen Prüfungen werden dabei durch die Errichtung einer interdisziplinär zusammengesetzten Ethik-Kommission für komplexe Prüfungen beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) einerseits angestrebt. Zudem werden mit dem MFG als Kernstück die strahlenschutzrechtlichen Anzeige- und Genehmigungsverfahren in das Genehmigungsverfahren der klinischen Prüfung integriert, wodurch sich Bearbeitungszeiten deutlich verkürzen und durch die Verzahnung zeit- sowie kostenintensive Antragseinreichungen bei verschiedenen Behörden entfallen werden. Auch für mononationale klinische Prüfungen werden die Bearbeitungszeiten verkürzt.6
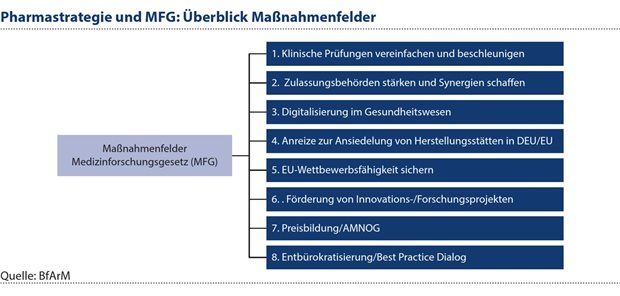
Abbildung 2: Mit dem MFG wird insbesondere das Ziel verfolgt, den rechtlichen Rahmen für die Durchführung von klinischen Studien verbessern, bürokratische Prozesse und Genehmigungsverfahren bei klinischen Studien und Zulassungsprogrammen vereinfachen und den Zugang zu Forschungsdaten erleichtern.
© Springer Medizin Verlag
BfArM und PEI unterstützen diese Initiativen zur Erleichterung klinischer Prüfungen nicht nur im Rahmen der Umsetzung und Implementierung der Vorgaben dieses Gesetzesentwurfes; gleichzeitig sind BfArM und PEI aktiv in die europäischen Maßnahmen zur Stärkung klinischer Studien in Europa („Accelerating Clinical Trials in Europe“7) eingebunden.
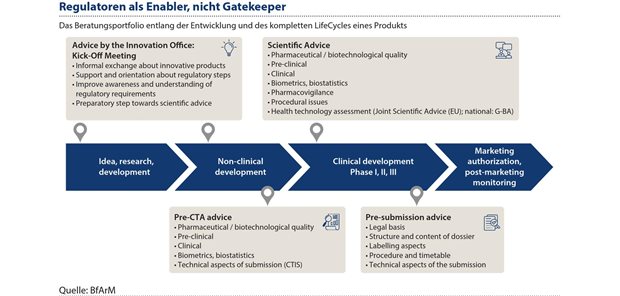
Abbildung 3: BfArM und PEI bereiten eine stärkere Zusammenarbeit mit dem Ziel einer rascheren Verfahrensbearbeitung intensiv vor, insbesondere durch die im Medizinforschungsgesetz vorgesehene zentrale Koordinierung und das Verfahrensmanagement für Zulassungsverfahren, Beratungen und Anträge zu klinischen Prüfungen.
© Springer Medizin Verlag
BfArM und PEI begrüßen und bereiten eine stärkere Zusammenarbeit, insbesondere durch die im MFG vorgesehene zukünftige zentrale Koordinierung und das Verfahrensmanagement für Zulassungsverfahren, Beratungen und Anträge zu klinischen Prüfungen aus dem BfArM heraus, zur rascheren Verfahrensbearbeitung intensiv vor. Damit leisten die beiden Bundesoberbehörden gemeinsam einen wesentlichen Beitrag zur Erreichung der Ziele der Pharmastrategie und des MFG im Sinne einer zukunftsfähigen Gesundheitsversorgung für die Patientinnen und Patienten in Deutschland und darüber hinaus. BfArM und PEI sehen sich, unter anderem auch durch das etablierte umfassende Beratungsangebot entlang des Lebenszyklus innovativer Arzneimittel und Technologien, als Enabler und Treiber einer modernen Gesundheitsversorgung (siehe Abbildung 3).
Das MFG ist eng verzahnt mit dem Gesundheitsdatennutzungsgesetz und dem Digitalgesetz zur Stärkung der Digitalisierung in der Gesundheitsversorgung als ein weiterer Faktor der Zukunftsfähigkeit:
Digitalisierung im Gesundheitswesen und Datenzugang – Weiterentwicklung Forschungsdatenzentrum Gesundheit durch Gesundheitsdatennutzungsgesetz und Digitalgesetz
Die Digitalisierung bietet enormes Potenzial, das Gesundheitswesen zu revolutionieren. Sie ermöglicht nicht nur eine optimale Versorgung der Menschen und die Entwicklung neuer Therapien, sondern auch eine effiziente Gesundheitsversorgung. Im Zentrum dieses Wandels steht die intelligente, zielführende Nutzung der stetig wachsenden Menge von Gesundheitsdaten, einschließlich der sogenannten Real-World-Daten, die aus der Praxis und von Krankenkassen stammen.
Diese Daten bilden eine wesentliche Grundlage für wegweisende Forschung im Gesundheitswesen. Das Forschungsdatenzentrum Gesundheit (FDZ) am BfArM, welches sich gerade im Aufbau befindet,8 hat die Aufgabe, Daten von gesetzlich Krankenversicherten an berechtigte Institutionen für Forschungszwecke zugänglich zu machen. Die Arbeit des FDZ Gesundheit ist in die Daten- und Pharmastrategie des Bundes eingebettet, die darauf abzielen, die Chancen von Daten für die Gesellschaft zu nutzen.
Mit dem Aufbau des FDZ Gesundheit wird sich die Nutzung von Real-World-Daten merklich verbessern. Ein Zugang zu solchen Daten kann schneller und qualifizierter, bei Sicherung von Datenschutzaspekten, erfolgen. Künftig werden im FDZ Gesundheit eine große Bandbreite der Abrechnungsdaten aller gesetzlich versicherten Menschen in Deutschland sowie perspektivisch Daten aus der elektronischen Patientenakte für Forschungsfragen zur Verfügung stehen. Neben ICD-codierten Diagnosen und OPS-codierten Prozeduren umfasst der Datenkranz der Krankenkassenabrechnungsdaten des FDZ Gesundheit auch Informationen zu Krankenhausaufenthalten, durchgeführten Operationen, verschriebenen Medikamenten und Facharztbesuchen (siehe Abbildung 4).
Neben den Potenzialen einer besseren Versorgung können durch die Analyse dieser im FDZ Gesundheit verfügbaren Daten Forschungsvorhaben durchgeführt werden, anhand derer Risikofaktoren und Frühwarnzeichen für bestimmte Krankheiten schnell identifiziert werden können. Durch rechtzeitige Interventions- und/oder Präventionsmaßnahmen können Krankheiten bereits in einem frühen Stadium erkannt und behandelt werden; dies kann zu effektiveren Behandlungsergebnissen und einer insgesamt verbesserten Gesundheitsversorgung beitragen. Insbesondere ermöglicht die Analyse großer Datenmengen im FDZ, individuelle Unterschiede in der Wirksamkeit von Behandlungen und Medikamenten besser zu verstehen.9 Dadurch können Informationen über die Wirksamkeit und Sicherheit von Therapien gesammelt werden, die das Wissen aus klinischen Studien ergänzen.
Diese Erkenntnisse können auf lange Sicht potenziell zur Verbesserung der Arzneimittelsicherheit und der frühzeitigen Erkennung von Risiken und Nebenwirkungen beitragen. Diese Potenziale werden auch in der Arzneimittelregulation gesehen, so dass zur Stärkung der Rolle der Real-World-Evidence vom European Medicines Regulatory Network (EMRN) eine entsprechende Strategie entwickelt und veröffentlicht wurde.10 Ein EU-weites Projekt, Real4Reg, widmet sich der zielführenden Nutzung von großen Datenmengen für regulatorische Fragestellungen.11
Insgesamt eröffnet das FDZ Gesundheit neue Möglichkeiten für die medizinische Forschung, verbesserte Versorgung und Erkenntnisgewinn für die Gesundheit der Bevölkerung. Es fördert die evidenzbasierte Medizin und ermöglicht die Nutzung umfangreicher Real-World-Daten, was der Wissenschaft, der Gesundheitsversorgung und der gesamten Gesellschaft zugutekommt.
Mit dem Gesundheitsdatennutzungsgesetz (GDNG)12 wird auch das FDZ kontinuierlich weiterentwickelt. Für die Antragsberechtigung sind zukünftig die im Gemeinwohl liegenden Nutzungszwecke ausschlaggebend, die gesetzlich im GDNG festgelegt sind, und nicht mehr, wer den Antrag stellt. Zudem kann das FDZ zukünftig pseudonymisierte Daten mit Daten aus gesetzlich geregelten medizinischen Registern wie dem Krebsregister verknüpfen, wenn dies für den antragsgemäßen Forschungszweck erforderlich ist und die Interessen der Versicherten hinreichend gewahrt werden.
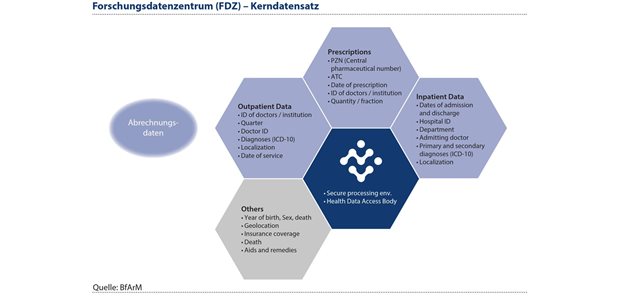
Abbildung 4: Künftig werden im FDZ Gesundheit eine große Bandbreite der Abrechnungsdaten aller gesetzlich versicherten Menschen in Deutschland sowie perspektivisch Daten aus der elektronischen Patientenakte für Forschungsfragen zur Verfügung stehen.
© Springer Medizin Verlag
Eine zentrale Datenzugangs- und Koordinierungsstelle für die Nutzung von Gesundheitsdaten wird bürokratische Hürden abbauen und den Zugang zu Forschungsdaten erleichtern. Hier werden erstmalig Gesundheitsdaten aus verschiedenen Datenquellen zu Forschungszwecken miteinander verknüpft werden können. Die Zugangsstelle soll als zentrale Anlaufstelle für Datennutzende fungieren. Die Datenhaltung erfolgt weiterhin dezentral, indem die Daten am bisherigen Ort gespeichert bleiben und lediglich spezifisch für den jeweiligen Forschungsantrag in einer sicheren Verarbeitungsumgebung zugänglich gemacht werden.
Das Digitalgesetz (DigiG)13 wiederum konzentriert sich auf die Digitalisierung des Gesundheitswesens und soll Innovationen im Bereich der digitalen Gesundheit fördern und digitale Ansätze tiefer in Versorgungsprozesse integrieren. Es beinhaltet Maßnahmen wie die Förderung von telemedizinischen Ansätzen, die Einführung von E-Rezepten und elektronischer Patientenakte mit höherer Verbindlichkeit und die Stärkung der IT-Infrastruktur im Gesundheitswesen sowie die Erweiterung des Bewertungsrahmens digitaler Gesundheitsanwendungen (DiGA) durch das BfArM auf digitale Gesundheitsangebote höherer Risikoklassen (Klasse IIb).
Der Blick nach Europa: EHDS und EU-HTA schaffen weitere wichtige Voraussetzungen für eine Zusammenarbeit zur Weiterentwicklung der Gesundheitsversorgung
Parallel zur Wegbereitung einer besseren Datenverfügbarkeit auf nationaler Ebene wurde Anfang März 2024 eine Verordnung über die Schaffung des Europäischen Raums für Gesundheitsdaten beschlossen. Das Europäische Gesundheitsdatennetzwerk (EHDS) ist ein europäisches Projekt, welches darauf ausgerichtet ist, den Austausch von Gesundheitsdaten zwischen den Mitgliedstaaten zu verbessern, um die Gesundheitsforschung und die Patientenversorgung zu unterstützen.
Die deutschen Gesetze zur Medizinforschung, Digitalisierung und Gesundheitsdatennutzung sind eng mit dem EHDS verbunden, da sie die rechtlichen Rahmenbedingungen schaffen, die für die Teilnahme Deutschlands an diesem Netzwerk erforderlich sind und die Nutzung von Gesundheitsdaten (Sekundärnutzung) über nationale Grenzen hinweg ermöglichen. Zur Vorbereitung auf den EHDS ist das BfArM an einer Vielzahl an Projekten und EU-weiten Initiativen beteiligt (THEDaS Joint Action14; HealthData@Eu Pilot Project15; DARWIN@EU16).
Durch die neue EU-HTA-Verordnung wird ab Januar 2025 eine harmonisierte Nutzenbewertung – das sogenannte „Joint Clinical Assessment“ der HTA-Institutionen – innovativer Arzneimittel und ausgewählter Medizinprodukte parallel zur Zulassung durchgeführt werden. Damit verbundene Ziele sind hier ebenfalls ein schnellerer, EU-weiter Zugang zu innovativen Arzneimitteln und die Verringerung von Doppelarbeit durch eine zentrale Antragsstellung anstelle mehrerer Einreichungen bei unterschiedlichen HTA-Institutionen.17
Insbesondere der bereits parallel zur Zulassung stattfindende harmonisierte Prozess der HTA-Bewertung stellt eine Neuerung dar, die eine enge Abstimmung zwischen den für die Zulassung und den für die Nutzenbewertung innovativer Technologien zuständigen Institutionen erfordert.
Die betroffenen Institutionen arbeiten bereits in der Implementierungsphase eng zusammen und bauen dabei auf den Erfahrungen aus der seit 2010 bestehenden bisherigen freiwilligen Zusammenarbeit im European Network for Health Technology Assessment, EUnetHTA, bzw. auf nationaler Ebene zwischen BfArM/PEI und Gemeinsamen Bundesausschuss (G-BA) auf.
Neben der formalen Implementierung der Vorgaben aus der EU-HTA-Verordnung adressieren die gemeinsamen Aktivitäten und Kooperationen zwischen Zulassungs- und HTA-Institutionen auch spezielle Aspekte wie die Anwendbarkeit von Real-World-Evidence gleichermaßen für Zulassungs- und HTA-Fragestellungen sowie allgemeinerer Natur zu Herausforderungen bei Evidenzgenerierung bei innovativen Ansätzen (entlang des gesamten Lebenszyklus der therapeutischen Intervention). So werden auch HTA-Vertreter aktiv im DARWIN EU Advisory Board mit eingebunden. Die Zulassungs- und HTA-Behörden bieten gemeinsame Beratungen zur Evidenzgenerierung sowohl mit Blick auf die Anforderungen für die Zulassungs- als auch für die HTA-Bewertung an. Der Mehrwert dieser gemeinsamen Beratungen ist allgemein anerkannt und wird auch von den beteiligten Institutionen als wichtige Säule der zukünftigen Zusammenarbeit zur Unterstützung innovativer Entwicklungsansätze gesehen.18
BfArM als Partner und Enabler für eine zukunftsfähige moderne Gesundheitsversorgung
Die Pharma- und Digitalstrategie haben zum Ziel, eine zukunftsfähige zuverlässige Versorgung sicherzustellen. Bei den zentralen Maßnahmen der auf Basis dieser Strategien kürzlich in Kraft getretenen Gesetze (DiGiG und GDNG) bzw. aktuellen Gesetzesentwürfen (Entwurf für ein MFG) kommen dem BfArM zentrale Aufgaben bei der Vereinfachung und Beschleunigung von klinischen Prüfungen und Genehmigungsprozessen, weiteren Entbürokratisierungsmaßnahmen sowie bei der zukünftigen zielführenden Nutzung stetig wachsender Mengen von Gesundheitsdaten zu.

Abbildung 5: Das BfArM unterstützt und begleitet die gesetzlichen Initiativen auch durch Maßnahmen zur frühzeitigen Identifizierung neuer Trends, durch Anwendung von Methoden des maschinellen Lernens/Künstlicher Intelligenz sowie durch den offenen Dialog mit allen Stakeholdern.
© Springer Medizin Verlag
Das BfArM geht diese sowie die mit immer schnelleren Entwicklungszyklen neuer Technologien verbundenen Herausforderungen – und Chancen – sowie die Umsetzung dieser auf eine zukunftsfähige, moderne Gesundheitsversorgung ausgerichteten Initiativen als Partner an. Das BfArM unterstützt und begleitet dabei auch durch Maßnahmen zur frühzeitigen Identifizierung neuer Trends und Befassung mit damit verbundenen möglichen Herausforderungen, durch Anwendung moderner Techniken wie Methoden des maschinellen Lernens/Künstlicher Intelligenz sowie durch den offenen Dialog mit allen an der Entwicklung innovativer Arzneimittel und Medizinprodukte beteiligter Institutionen (siehe Abbildung 5).

© BfArM/Jörn Wolter
Professor Dr. Karl Broich,
Humanmediziner (Approbation 1985, Promotion 1986); Arzt für Neurologie und Psychiatrie (Nervenheilkunde 1993); Zusatztitel Psychotherapie mit Schwerpunkt Verhaltenstherapie (1999). 2000 bis 2009 zunächst Fachgebietsleiter Neurologie/Psychiatrie, dann Abteilungsleiter Zulassung 4 im BfArM; ab 2009 Vizepräsident, seit 2014 Präsident des BfArM.

© BfArM/Jörn Wolter
Dr. Wiebke Antonia Löbker,
Apothekerin (Fachapothekerin für Arzneimittelinformation); 2009-2011 wissenschaftliche Mitarbeiterin am Institut für Pharmazie der Freien Universität Berlin, Fachbereich Pharmakologie & Toxikologie; 2011-September 2016 Referentin in der Abteilung Arzneimittel des Gemeinsamen Bundesausschusses, Berlin; seit Oktober 2016 unter anderem Leiterin des Innovationsbüros beim BfArM.
Literatur
1 EMA Homepage: Monitoring the European clinical trials environment. A deliverable of the ACT EU Priority Action 2 – February 2024; https://go.sn.pub/3w0twq, abgerufen am 26.03.2024
2 Studie Pharmainnovationsstandort Deutschland, vfa und kearney, © 2023, https://go.sn.pub/2wi27z, zuletzt abgerufen am 08.05.2024
3 Pharmastrategie https://go.sn.pub/csrx81
4 Digitalisierungsstrategie, https://go.sn.pub/kvevj2, zuletzt abgerufen am 1. Mai 2024
5 Entwurf für ein Medizinforschungsgesetz, https://go.sn.pub/12nc4m, zuletzt abgerufen am 1. Mai 2024
6 https://go.sn.pub/csrx81, zuletzt abgerufen am 1. Mai 2024
7 https://go.sn.pub/gtcftr, zuletzt abgerufen am 2. Mai 2024
8 https://go.sn.pub/u3jc62, zuletzt abgerufen am 3. Mai 2024
9 Ludwig, M., Schneider, K., Heß, S. et al. Aufbau des neuen „Forschungsdatenzentrums Gesundheit“ zur Datenbereitstellung für die Wissenschaft. Bundesgesundheitsbl 67, 131–138 (2024). https://doi.org/10.1007/s00103-023-03831-z
10 Arlett P, Kjaer J, Broich K, Cooke E (2022) Real-world evidence in EU medicines regulation: enabling use and establishing value. Clin Pharmacol Ther 111(1):21–23. https://doi.org/10.1002/cpt.2479; Referenz 11 – EMRN Strategy; https://go.sn.pub/kmtub5
11 https://www.real4reg.eu/, zuletzt abgerufen am 3. Mai 2024
12 https://go.sn.pub/y0oyhh
13 https://go.sn.pub/w6f449
14 https://tehdas.eu/
15 https://ehds2pilot.eu/
16 https://www.darwin-eu.org/
17 https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32021R2282
18 Regulatory, HTA and payer interactions and collaborations: optimising their use and outcome success, CIRS workshop 10-11th March 2021; https://cirsci.org/wp-content/uploads/dlm_uploads/2022/01/CIRS-March-2021-workshop-report-Interactions-and-collaborations.pdf




