Plattform zur Nutzenbewertung – No. 18
Stärken und Schwächen von HTA in Frankreich
Die Anerkennung innovativer Arzneimittel in Frankreich ist an den klinischen Mehrwert gebunden, den die Haute Autorité de Santé (HAS) gewährt. Dazu gehört der Nachweis der Wirksamkeit gegenüber einem geeigneten Vergleichspräparat mit einem hohen Evidenzgrad, in der entsprechenden Population und mit einem klinisch relevanten Ausmaß der Wirkung. Dieser selektive Ansatz zielt darauf ab, die Herausforderungen im Zusammenhang mit Innovationen zu bewältigen: eine dem Umfang der Innovation entsprechende Vergütung, aber auch die Aufrechterhaltung des Gesundheitssystems. Er basiert auf einer starken, wissenschaftlichen und unabhängigen Agentur mit einer klaren Definition von Innovation und der Art und Weise, wie sie dem HTA-Ausschuss im Rahmen des Early-Access-Programms sowie für das reguläre Verfahren präsentiert wird. Es wird dann angepasst, um der Bevölkerung die beste Gesundheitsversorgung mit so viel Sicherheit wie möglich zu bieten.
Veröffentlicht:
© picture alliance / PHOTOPQR/LE PARISIEN/MAXPPP
Von den folgenden neuen Medikamenten, die vom Transparenzausschuss (TC) der Haute autorité de santé (HAS), dem französischen Gremium für Gesundheitstechnologie, bewertet wurden, sind nur wenige als innovativ eingestuft worden. Zolgensma® (Onasemnogene abeparvovec), Raxone® (Idebenone), Glibera® (Alipogène tiparvovec), Kaftrio® (Vacaftor/Tezacaftor/Elexacaftor), Sovaldi® (Sofosbuvir), Veklury® (Remdesivir), Carvykti® (Ciltacabtagene Autoleucel), Zalmoxis® (allogene T-Zellen), Dupixent® (Dupilumab), Spherox® (Chondrozyten in Sphäroiden).

© cacaroot / stock.adobe.com | Springer Medizin Verlag
Dieser Beitrag ist im Rahmen der Plattform zur Nutzenbewertung entstanden und im Februar 2024 in Heft 18 („AMNOG 2.0: Auf dem Weg zu einem effizienten System“) erschienen.
AMNOG2.0 - Auf dem Weg zu einem effizienten System (4504 kB)
Obwohl es sich bei diesen Arzneimitteln um Gentherapeutika, Zelltherapien, Biotherapien oder Arzneimittel handelt, die auf eine neue Wirkungsweise, sehr schwere Krankheiten oder eine Krankheit mit hohem medizinischem und therapeutischem Bedarf abzielen, war dies für den Transparenzausschuss nicht ausreichend, um den erzielten Fortschritt gegenüber der bereits bestehenden therapeutischen Strategie anzuerkennen und diese Arzneimittel als innovativ einzustufen.
Die Anerkennung der Innovation beruht nicht auf dem Wirkmechanismus, selbst wenn dieser neu und ausgefeilt ist, oder auf der Schwere oder Seltenheit der Krankheit. Nur Zolgensma®, Kaftrio®, Sovaldi® und Dupixent® wurde vom Transparenzausschuss die Anerkennung eines klinischen Zusatznutzens gewährt (ein ASMR von II, III oder IV bei der ersten Bewertung), unter Berücksichtigung des angemessenen Nachweises einer Wirksamkeit auf klinisch relevante Endpunkte, gegenüber dem geeigneten Vergleichspräparat mit einem hohen Evidenzgrad, in der entsprechenden Population und schließlich mit einem klinisch relevanten Ausmaß der Wirkung. Folgende Anforderungen sind in der Doktrin des Transparenzausschusses (TC) aufgeführt.1
Die Bewertung des klinischen Mehrwerts, die für die Anerkennung der Innovation erforderlich ist, folgt den in Abbildung 1 dargestellten aufeinanderfolgenden Schritten der Bewertung.
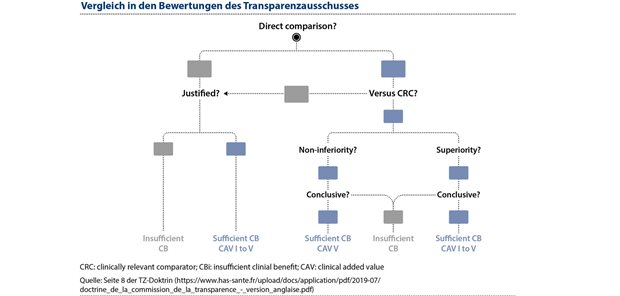
Abbildung 1: Die Bewertung des klinischen Mehrwerts, der für die Anerkennung der Innovation erforderlich ist, folgt einer Serie aufeinanderfolgender Schritte.
© SMV
Diese Doktrin ist keine doktrinäre Sichtweise des HTA; sie ist ein Leitfaden, um zu verstehen, wie der TC Arzneimittel bewertet, hauptsächlich auf der Grundlage der evidenzbasierten Medizin. Dadurch wird die Anerkennung von Innovationen ermöglicht.
Die Herausforderungen der Innovation müssen unterstützt werden, und es muss aufgezeigt werden, wie sie in das Gesundheitssystem integriert werden können. In Frankreich gilt die Regel, dass für Innovationen bezahlt wird, und zwar je nach Umfang der Innovation: Je innovativer eine Gesundheitstechnologie ist, desto höher ist ihr Preis. Daraus ergibt sich die Notwendigkeit eines regulierten Preises und der Begrenzung des Preises für nicht-innovative Arzneimittel.
Um dies zu erreichen, wurde Anfang der 2000er Jahre beschlossen, eine unabhängige, starke und wissenschaftliche Agentur, die Haute autorité de santé, einzurichten, in die der bereits bestehende Transparenzausschuss integriert wurde. Die Agentur und der Ausschuss können Stellungnahmen zu Gesundheitstechnologien abgeben, und zwar nach einem hohen Beurteilungsstandard und mit einem hohen Maß an Unabhängigkeit und Freiheit, und öffentlich äußern, was über den klinischen Nutzen eines Medikamentes gesagt werden kann. Es wird dann angepasst, um der Bevölkerung die beste Gesundheitsversorgung mit so viel Sicherheit wie möglich zu bieten, abhängig von den verfügbaren Daten.
Neben dem medizinischen und wissenschaftlichen Ziel, eine möglichst optimale medizinische Behandlung zu gewährleisten, gibt es auch ein wirtschaftliches Anliegen, wenn man davon ausgeht, dass Gesundheitstechnologien das Wirtschaftswachstum vorantreiben und einen innovativen Wirtschaftszweig darstellen, wie es in der EU-Verordnung 2021/2282 über die Bewertung von Gesundheitstechnologien heißt: „Die Entwicklung von Gesundheitstechnologien ist eine wichtige Triebkraft für Wirtschaftswachstum und Innovation in der Union und der Schlüssel zur Erreichung des hohen Gesundheitsschutzniveaus, das die Gesundheitspolitik zum Wohle aller gewährleisten muss. Gesundheitstechnologien stellen einen innovativen Wirtschaftssektor dar und sind Teil eines Gesamtmarktes für Gesundheitsausgaben, der zehn Prozent des Bruttoinlandsprodukts der Union ausmacht.“2
Dies sind die Herausforderungen für die HTA-Agentur und HTA in Frankreich. Wie kann man Innovationen im Gesundheitsbereich erkennen? Die Antwort des französischen HTA-Gremiums lautet:
- Eine operative Definition bereitstellen,
- Anpassung der Definition an den jeweiligen Kontext; es kann nicht nur eine Definition geben,
- Bereitstellung einer klaren, gemeinsamen und reproduzierbaren Methode zur Bewertung eines bestimmten Arzneimittels auf der Grundlage dieser Definition,
- Die Gleichheit der Bewertung zwischen den Arzneimitteln und im Laufe der Zeit aufrecht zu erhalten,
- Eine solide Bewertung der Innovation, um unangemessene Empfehlungen zu vermeiden.
Dies wird durch das Programm für den frühzeitigen Marktzugang deutlich, eine frühere befristete Nutzungsgenehmigung (ATU), die von der ANSM (der französischen Arzneimittelbehörde) erteilt wurde und 2021 tiefgreifend geändert und auf die HAS übertragen wurde und nun als vorgezogene Zugangsgenehmigung (AAP) bezeichnet wird. Eines der fünf kumulativen Kriterien, die für die AAP erfüllt sein müssen, ist eine vermeintliche Innovation durch das Arzneimittel (siehe Abbildung 2).
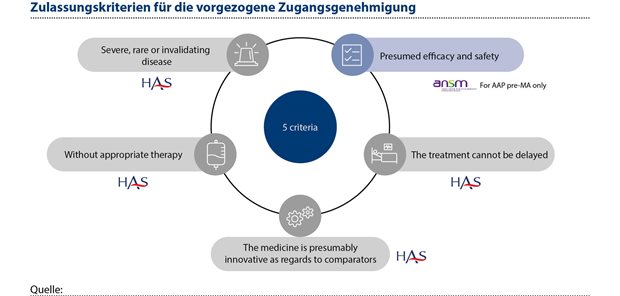
Abbildung 2: Eines der fünf kumulativen Kriterien, die für die vorgezogene Zugangsgenehmigung (AAP) erfüllt sein müssen, ist eine vermeintliche Innovation durch das Arzneimittel.
© SMV
Im Zusammenhang mit AAPs umfasst die Definition von Innovation eine neue Behandlungsmodalität (bei der es sich um einen neuen Wirkmechanismus handeln kann), die einen erheblichen klinischen Nutzen für den Patienten bringt. Im Sinne einer frühzeitigen Verfügbarkeit des Arzneimittels können die vorläufigen Daten akzeptiert werden, wenn ein geeigneter Entwicklungsplan vorliegt, der diese vorläufigen klinischen Ergebnisse ergänzt und die Ungewissheiten ausräumt. Die Lücken und Ungewissheiten in Bezug auf den Nachweis der Wirksamkeit und Sicherheit gegenüber einer therapeutischen Referenzstrategie müssen zeitnah geschlossen werden. Das dritte Definitionskriterium ist, dass das Arzneimittel einen bislang unzureichend gedeckten medizinischen Bedarf deckt.
Die Änderung des frühen Marktzugangs von ATU zu AAP hat die Bedingungen für die Gewährung des frühzeitigen Zugangs zu Arzneimitteln durch die Einführung einer HTA-Perspektive mit der frühzeitigen Anerkennung einer vermeintlichen Innovation tiefgreifend verändert. Die Idee dieser Reform bestand auch darin, die Kontinuität zwischen der frühzeitigen Bewertung und damit dem frühzeitigen Zugang und dem allgemeinen Zugang zum Markt zu gewährleisten.
Die AAP hat auch die Notwendigkeit einer Datenerhebung unterstrichen, die es ermöglicht, die klinische Situation der behandelten Patienten, die Wirksamkeit und Sicherheit in einem realen Kontext zu beschreiben. Die Anerkennung einer vermeintlichen Innovation ist mit einem vom Unternehmen festgelegten Preis verbunden, der bis zu einer bestimmten Grenze und mit kumulativen Abschlägen erstattet wird, die von Ereignissen abhängen, wie z. B. dem Scheitern der Zulassung, der niedrigen Bewertung des HTA-Gutachtens, dem Fehlen einer Preisvereinbarung mit dem Wirtschaftsausschuss für das Gesundheitswesen (CEPS) und/oder der Erstattung eines neuen Arzneimittels, das nach Ansicht des HAS den therapeutischen Bedarf in der Indikation AAP (besser) erfüllt.
Die andere mögliche Definition von Innovation ergibt sich aus der Bewertung des klinischen Mehrwerts (ASMR: Amelioration du service medical rendu). Diese Bewertung stützt sich auf drei Säulen:
- Evidenzgrad – Qualität des Nachweises, der das Design für den Vergleich umfasst, das heißt, die Wahl der Komparatoren, die allgemeine methodische Qualität der Studie, die Angemessenheit der Population für die Indikation, die klinische Relevanz der wichtigsten Endpunkte...,
- Ausmaß der klinischen Wirkung in Bezug auf Wirksamkeit, Effektivität, Lebensqualität und moduliert durch die klinischen Auswirkungen des Sicherheitsprofils,
- Klinische Relevanz der Wirkung im Vergleich zum klinisch relevanten Komparator.
Diese beiden Säulen werden im Hinblick auf die medizinische Notwendigkeit betrachtet.
Je mehr die Bewertung zu dem Schluss kommt, dass diese Anforderungen erfüllt sind, desto wahrscheinlicher ist die Anerkennung der Innovation.
Die Doktrin besagt folgendes3: „Der TC kann ein Arzneimittel als bedeutenden therapeutischen Fortschritt [ASMR I] anerkennen, wenn dieses einen neuen Wirkmechanismus aufweist, mit einem hohen Evidenzgrad seine Überlegenheit in Verbindung mit einer klinisch relevanten Wirkung in Bezug auf Mortalität und Morbidität im Vergleich zu einem klinisch relevanten Vergleichspräparat in einem Kontext eines unzureichend gedeckten medizinischen Bedarfs für eine schwere Krankheit nachgewiesen hat.“
Diese Bewertung entspricht bahnbrechenden therapeutischen Entwicklungen (die das Leben von Patienten mit einer schweren Krankheit retten oder verändern), bei denen der Ausschuss alle Faktoren des klinischen Mehrwerts als vollständig erfüllt ansieht.
Der TC kann ein Arzneimittel als wichtigen oder mäßigen therapeutischen Fortschritt [ASMR II oder III] anerkennen, wenn es eine nachgewiesene Überlegenheit in Verbindung mit klinischer Wirksamkeit in Bezug auf Mortalität und Morbidität in einem Kontext eines bislang unzureichend gedeckten medizinischen Bedarfs aufweist. Die Bewertung dieser Wirksamkeit kann durch eine wesentliche Verbesserung der Lebensqualität und/oder der Sicherheit positiv beeinflusst werden. Eine starke oder mäßige ASMR qualifiziert den klinischen Mehrwert, je nach ihrer Intensität, der Qualität des Nachweises und der Schwere der Krankheit oder des Symptoms. Der dem Fortschritt zugeschriebene Wert steigt also mit der Größe des Effekts, der Qualität des Nachweises und der Schwere der Krankheit.
Ein geringer klinischer Zusatznutzen [ASMR IV] wird einem Fortschritt zugesprochen, der im Vergleich zu bestehenden Therapien gering ist. Er entspricht einem nicht optimalen Nachweis und/oder einer nicht optimalen Effektgröße (Wirksamkeit, Lebensqualität, Unbedenklichkeit) angesichts des medizinischen Kontextes. Es kann sich um ein Arzneimittel handeln, das eine relevante Wirksamkeit mit einer geringfügigen und akzeptablen Beeinträchtigung der Lebensqualität oder der Sicherheit gezeigt hat. Umgekehrt kann es sich um ein Arzneimittel mit geringer oder nicht optimal nachgewiesener zusätzlicher Wirksamkeit handeln, das jedoch mit einer Verbesserung der Lebensqualität oder der Sicherheit verbunden ist. Es kann sich um eine wesentliche Verbesserung der Versorgungsbedingungen handeln, die entweder nachgewiesen oder vom HTA erwartet wird.
Die Ausarbeitung dieser Doktrin und die Klärung der Art und Weise, wie Arzneimittel vom HTA-Ausschuss bewertet werden, die öffentlich zugänglich sind, wurde durch die Schaffung einer unabhängigen öffentlichen Agentur ohne staatliche Aufsicht und mit ergänzenden Aufgaben, einschließlich HTA für Arzneimittel, Medizinprodukte und Verfahren sowie klinische Leitlinien, möglich. Die Stärke des HTA beruht auch auf einer konsequenten Nutzung der verfügbaren Methodik und der Evidenzbasierten Medizin bei Unsicherheiten in der Entscheidungsfindung. Alle für eine Erstattung in Frage kommenden Arzneimittel werden bewertet und können bei Bedarf jederzeit neu bewertet werden. Der TC kann die Erhebung von Daten aus der Praxis verlangen. Die Klärung der Bewertungsmodalitäten durch die Veröffentlichung der Doktrin seit 2011, die regelmäßig aktualisiert wird, hat zu einer besseren Lesbarkeit des Ansatzes und vielleicht zu einer besseren Vorhersehbarkeit der Schlussfolgerungen geführt.
Die Stellungnahmen des HAS werden von den Entscheidungsträgern (Ministerium für Gesundheit und soziale Sicherheit, nationale Krankenkasse) zu 100 Prozent befolgt. Sie gelten als solide, und es gibt kaum Rechtsstreitigkeiten darüber.
Es gibt immer noch einige Meinungsverschiedenheiten über die Anwendung der evidenzbasierten Medizin, über die niedrige Zahl der ASMR I, II, III, was zu schwierigen Preisverhandlungen führt und niedrigere Preise ergibt, als die Pharmaindustrie erwartet. Das ist die Kehrseite der Medaille für die Anerkennung von Innovation in Verbindung mit einem höheren Preis und der Förderung der wirtschaftlichen Entwicklung durch die Begünstigung der Arzneimittelindustrie in einer wirtschaftlichen Situation, in der die Ausgaben für die Gesundheitsversorgung begrenzt werden müssen.
Es besteht auch ein Spannungsfeld zwischen den Anforderungen des HAS in Bezug auf die Evidenz und dem Nachweis des Ausmaßes einer Wirkung im Vergleich zu einer geeigneten Vergleichsgruppe. Es muss anerkannt werden, dass dieser Nachweis eine lange und kostenintensive Entwicklung erfordert. Der derzeitige Trend zu kurzen, nicht vergleichenden Studien, die nicht geeignet sind, den Mehrwert des Medikaments nachzuweisen, zielt jedoch darauf ab, die Rechtfertigung einer Innovation zu unterstützen, die zu einem hohen Preis führen sollte. Dieses Spannungsfeld ist immer noch nicht gelöst, obwohl HAS alle Anstrengungen unternommen hat, um zu definieren, wann ein atypisches Design von klinischen Studien für die Anerkennung von Innovationen akzeptiert werden kann.4
Diese Bewertungsmodalitäten werden höchstwahrscheinlich in das Verfahren integriert, sobald neue Arzneimittel mit EU-Zulassung von den Mitgliedstaaten im Rahmen der gemeinsamen klinischen Bewertungen bewertet werden. Man sollte jedoch bedenken, dass es sich bei den gemeinsamen klinischen Bewertungen um Beurteilungen und nicht um Bewertungen handelt, die ein nationales Privileg bleiben. Die Entscheidungen über die Innovation werden weiterhin auf nationaler Ebene getroffen.
Es gibt noch viele andere Gesichtspunkte, die ausgebaut werden könnten: die Beteiligung der Patienten an der HTA, einschließlich der frühzeitigen Erkennung von Innovationen, ihre Beteiligung an der Bewertung auf europäischer Ebene, aber auch die Fristen für den Zugang zu Innovationen etc. Diese Themen könnten als spezifische Themen in weiteren Konferenzen erarbeitet werden.
Obgleich ich als ehemaliges Mitglied des HAS wahrscheinlich eine voreingenommene Sichtweise habe, sind bis dahin das subtile Gleichgewicht zwischen einem starken HTA-Gremium, einer klar definierten Art der Bewertung von Arzneimitteln und einem hohen Maß an Anerkennung von Innovationen durch Preispräferenzen die Schlüsselelemente des französischen HTA mit all seinen Stärken und Schwächen.

© privat
Dr. Anne d’Andon ist als unabhängige Beraterin im Bereich Marktzugang tätig. Als Ärztin arbeitete sie am INSERM, insbesondere im Bereich seltener Erkrankungen. Parallel dazu erwarb sie einen Master in Methodik und Biostatistik und einen Master in kardiovaskulärer Pharmakologie sowie Zertifikate in Humangenetik und Molekularbiologie.
Sie leitete nacheinander die Forschungsabteilungen von zwei Patientenvereinigungen, Vaincre la mucoviscidose (für Mukoviszidose) und AFM-Telethon (für Muskeldystrophien). Sie war stellvertretende medizinische Direktorin bei Genzyme. Anschließend leitete sie 10 Jahre die Abteilung für die Bewertung von Arzneimitteln bei der nationalen Gesundheitsbehörde (HAS).
Literatur
- Transparenzausschuss-Doktrin: Principes d’évaluation de la CT relatifs aux médicaments en vue de leur accès au remboursement. Aktualisiert am 15. Februar 2023. https://go.sn.pub/MW6x9C
- Verordnung (EU) 2021/2282 des Europäischen Parlaments und des Rates vom 15. Dezember 2021 über die Bewertung von Gesundheitstechnologien und zur Änderung der Richtlinie 2011/24/EU
- https://go.sn.pub/Ylr7A4
- Vanier A, Fernandez J Kelley S et al. 2023 Rapid access to innovative medicinal products while ensuring relevant health technology assessment (Rascher Zugang zu innovativen Arzneimitteln bei gleichzeitiger Gewährleistung einer angemessenen Gesundheitstechnologiebewertung). Position of the French National Authority for Health. (Position der nationalen Gesundheitsbehörde Frankreichs.) BMJ Evidence-Based Medicine Published Online First: 14 February 2023. doi: 10.1136/bmjebm-2022-112091




