Welche Endpunkte sind patientenrelevant?
Primäre Endpunkte im AMNOG: Standortbestimmung und Ausblick am Beispiel Onkologie
Die Festlegung von relevanten Endpunkten ist ein inhaltlich und methodisch kritischer Bestandteil der Konzeption klinischer Studien zu neuen Arzneimitteln. Die Selektion und Hierarchisierung der Endpunkte bestimmt das Design der Studie, die zu erhebenden Messparameter, die erforderliche Zahl an Studienteilnehmern, Abbruchkriterien und letztendlich den Zugang von Betroffenen zu einem neuen Arzneimittel. Die Studienergebnisse werden sowohl in den Verfahren zur Zulassung und zur Nutzenbewertung als auch zu Empfehlungen in Leitlinien genutzt – aber nicht mit derselben Methodik bewertet.
Veröffentlicht:
© virtua73 / stock.adobe.com
Einleitung
Vor allem die medikamentöse Therapie hat in den letzten beiden Jahrzehnten die Prognose von Patientinnen und Patienten (Pat.) mit einer Krebserkrankung deutlich verbessert. Höchstes Ziel bei der Behandlung dieser Pat. ist eine Heilung ohne negative Folgen. Voraussetzungen sind die Elimination der Krankheitsursache und die Verhinderung eines Rezidivs unter Einsatz nebenwirkungsarmer- oder freier Therapiestrategien. Bei vielen Krebserkrankungen ist dieses Ziel heute erreichbar. Die Chancen auf langfristige Heilung wurden insbesondere bei Pat. mit lokal begrenzter Erkrankung und hohem Rezidivrisiko erhöht, indem die wirksamen lokalen Maßnahmen wie Operation und/oder Bestrahlung mit dem Einsatz systemischer Therapie kombiniert wurden. Paradebeispiele sind Mamma-, Lungen- und kolorektales Karzinom.1-6
Der relativ größte Fortschritt wurde bei Pat. mit fortgeschrittenen, metastasierten oder primär systemischen Krebserkrankungen erzielt. Eine neue Erfahrung beim Einsatz der hochwirksamen Arzneimittel in diesem Patientenkollektiv ist die zunehmende Transformation von sehr fortgeschrittenen Krebserkrankungen mit einer begrenzten Lebenserwartung von Monaten bis zu wenigen Jahren in chronische Krankheiten mit einer annähernd normalen Lebenserwartung. Paradebeispiele sind das metastasierte Melanom7, biologisch definierte Subgruppen des metastasierten nichtkleinzelligen Lungenkarzinoms3,8,9 und hämatologische Neoplasien wie die Chronische Myeloische Leukämie10, das Multiple Myelom11 und die Chronische Lymphatische Leukämie.12

Abbildung 1: Überblick über die Zahl abgeschlossener Verfahren im Rahmen der frühen Nutzenbewertung 2012 bis 2024, begrenzt auf neue Arzneimittel bzw. neue Indikationen.
© DGHO
Erfahrungen aus dem AMNOG-Verfahren
Zwischen 2012 und 2024 wurden mehr als 300 Verfahren zu neuen Onkologika bzw. zu neuen Anwendungsgebieten im Rahmen des AMNOG-Prozesses durch den Gemeinsamen Bundesausschuss (G-BA) abgeschlossen. Die Anzahl aller abgeschlossenen Verfahren in der Onkologie liegt über 400, diese Zahl beinhaltet auch Neubewertungen, zum Beispiel nach Fristablauf.13 Abbildung 1 gibt einen Überblick über die Anzahl abgeschlossener Verfahren im Rahmen der frühen Nutzenbewertung 2012 bis 2024, begrenzt auf neue Arzneimittel bzw. neue Indikationen.
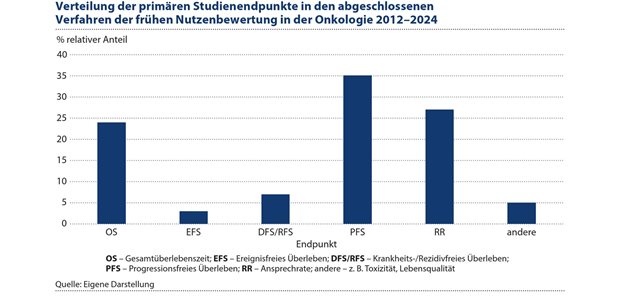
Abbildung 2: In der Mehrzahl der 333 ausgewerteten AMNOG-Verfahren war ein einziger primärer Endpunkt für die jeweilige Studie festgelegt. Zwei koprimäre Endpunkte wurden in 51 Verfahren verwendet.
© DGHO
Primäre Endpunkte
In der Onkologie werden in den Zulassungsstudien zahlreiche, unterschiedliche Endpunkte verwendet. Von besonderer Bedeutung ist die Festlegung des primären Endpunktes. In der großen Mehrzahl der 333 ausgewerteten Verfahren war ein einziger primärer Endpunkt für die jeweilige Studie festgelegt. Bei 51 Verfahren wurden zwei koprimäre Endpunkte verwendet, zum Beispiel Gesamtüberlebenszeit und progressionsfreies Überleben. Abbildung 2 gibt einen Überblick über die Anzahl der verwendeten Endpunkte in den abgeschlossenen Verfahren der Jahre 2012 bis 2024.
Im untersuchten Zeitraum zeigt sich eine deutliche Verschiebung in der Häufigkeit der Verwendung primärer Endpunkte, siehe Abbildung 3.
Rein deskriptiv ist die Anzahl von Verfahren mit dem primären Endpunkt ‚Gesamtüberleben (OS)‘ relativ konstant, während die Anzahl von Verfahren mit dem Endpunkt ‚Progressionsfreies Überleben (PFS)‘ vor allem in den Jahren 2019 bis 2022 deutlich zugenommen hat. In den letzten Jahren ist besonders die Anzahl von Verfahren mit dem primären Endpunkt ‚Ansprechrate (RR)‘ gestiegen.
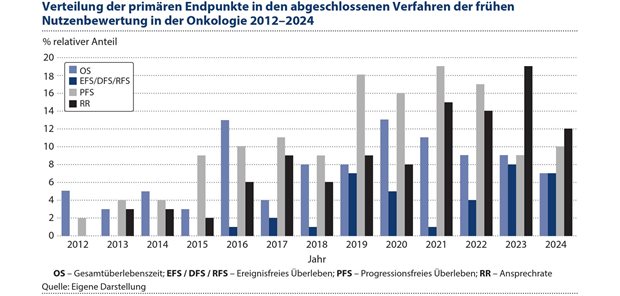
Abbildung 3: Die Verlängerung der Gesamtüberlebenszeit ist zwar für onkologische Patienten in der großen Mehrzahl der Indikationen der entscheidende Endpunkt. Sie war aber nur in 24 Prozent der abgeschlossenen Verfahren der primäre Endpunkt.
© DGHO
Mortalität – Gesamtüberlebenszeit
Die Verlängerung der Gesamtüberlebenszeit ist für onkologische Pat. in der großen Mehrzahl der Indikationen der entscheidende Endpunkt. Sie war allerdings nur in 24 Prozent der abgeschlossenen Verfahren der primäre Endpunkt. Die Verteilung dieses Endpunktes hat sich im Beobachtungszeitraum nicht wesentlich verändert, siehe Abbildung 3. Die Gesamtüberlebenszeit ist für die Erfassung der Wirksamkeit eines neuen Arzneimittels patientenrelevant, allerdings in der derzeit üblichen Form für eine Nutzenbewertung mit Schwächen behaftet.
Stärken
- Objektive Erfassung
- Gute Vergleichbarkeit mit Daten aus anderen Studien oder Registern
- Patientenrelevanz
Schwächen
- Überlebensrate: Die Überlebensrate wird selten als primärer Endpunkt oder überhaupt bewertet. Insbesondere bei der Chance einer nachhaltigen Verlängerung der Gesamtüberlebenszeit ist die Überlebensrate relevant für die Bewertung einer onkologischen Studie. Das traf in den letzten Jahren vor allem auf die Studien mit Immuncheckpoint-Inhibitoren zu.
- Durchführbarkeit von Studien: Für die Erfassung eines signifikanten Unterschieds ist eine sehr hohe Anzahl von Studienteilnehmern erforderlich, vor allem bei Erkrankungen mit guter Prognose.
- Verzerrungspotenzial: Die Erfassung der Gesamtüberlebenszeit erfordert die Erfassung aller nachfolgenden Therapien in dieser Indikation. Angesichts des weltweit sehr unterschiedlichen Zugangs zu weiteren neuen Arzneimitteln besteht ein hohes Verzerrungspotenzial. Auch ist bei einigen Studien in End-of-Life-Situationen ein Crossover-Design ethisch geboten. Es gibt derzeit keinen allgemein akzeptierten Konsens über die beste Methodik zur Berechnung von Crossover-Effekten. Bei hohen Crossover–Zahlen ändert sich auch der Inhalt der Fragestellung: Es wird nicht oder nicht nur der Wert eines neuen Arzneimittels oder Therapiekonzeptes, sondern sein Einsatz in einer frühen versus einer späten Krankheitsphase getestet.
- Fehlende Validierung: In vielen HTA-Methodologien ist das Ausmaß des relativen Unterschieds in der mittleren Überlebenszeit der relevante Bewertungsparameter.14 Damit führte auch 2024 ein absoluter Unterschied von <3 Monaten zum Vorschlag eines erheblichen Zusatznutzens, ohne nachhaltige Verlängerung der Überlebenszeit und vor allem auch ohne Erhöhung der Langzeitüberlebensrate.15
Morbidität – Krankheits-/Rezidivfreies Überleben (DFS/RFS) / Ereignisfreies Überleben (EFS)
Krankheits-/Rezidivfreies Überleben (DFS/RFS) und ereignisfreies Überleben (EFÜ, EFS) sind sinnvolle und gebräuchliche Endpunkte bei allen Therapieinterventionen mit kurativer Zielsetzung. Diese Endpunkte werden sowohl bei systemischen Erkrankungen wie akuten Leukämien als auch bei neoadjuvanter und adjuvanter Therapie eingesetzt.
Stärken
- Direkte Abbildung der Wirksamkeit der jeweiligen Intervention
- Kürzeres Zeitintervall bis zum Studienendpunkt im Vergleich zur Gesamtüberlebenszeit
- geringere Beeinflussung durch spätere Störfaktoren wie die Therapie im Rezidiv oder relevante, die Gesamtüberlebenszeit beeinflussende Komorbidität.
Schwächen
- Composite Endpoint: Alle zusammengesetzten Endpunkte haben ein höheres Verzerrungspotenzial durch unterschiedliche Gewichtung der eingeschlossenen Parameter. In einem System der Nutzenbewertung wie in Deutschland, bei dem HTA-Bewertung und Preisbildung im Wesentlichen auf dem Vergleich mit dem bisherigen Therapiestandard beruhen, ist die Einheitlichkeit der Definition von Composite Endpoints essenziell, aber auch schwerer zu erreichen.
- Überlagerung der Erfassung der Wirksamkeit eines neuen Arzneimittels durch hohe Therapie-assoziierte Toxizität und Letalität.
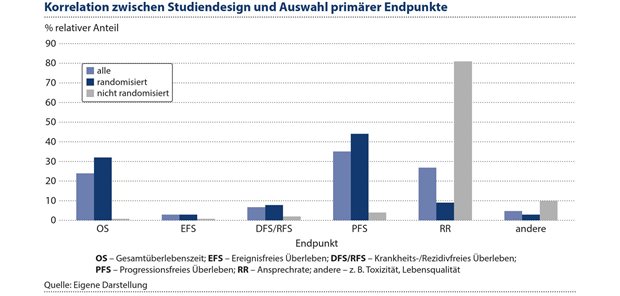
Abbildung 4: Der primäre Endpunkt der Remissionsrate ist vor allem bei nicht-randomisierten Studien verwendet worden. Deren Zahl ist in den vergangenen Jahren gestiegen.
© DGHO
Morbidität – Progressionsfreies Überleben (PFÜ)
Progressionsfreies Überleben oder Zeit bis zum Progress waren die am häufigsten verwendeten, primären Endpunkte bei Studien zur Wirksamkeit neuer Arzneimittel in der Onkologie in den letzten Jahren, siehe Abbildung 1. Progressionsfreies Überleben (PFÜ, PFS) ist ein sinnvoller und gebräuchlicher Endpunkt bei allen Therapieinterventionen mit nicht-kurativer Zielsetzung. Diese Endpunkte wurden in den letzten Jahren von der European Medicines Agency (EMA) und der US-amerikanischen Food and Drug Administration (FDA) bei sehr unterschiedlichen onkologischen Arzneimitteln und Therapieindikationen für die Zulassung neuer Arzneimittel akzeptiert. Die Zulassungsbehörden und HTA-Organisationen haben sich intensiv mit den methodischen Grundlagen beschäftigt.14, 16
Stärken
- Direkte Abbildung der Wirksamkeit der jeweiligen Intervention bei fortgeschrittenen Erkrankungen und bei Therapie in nicht-kurativer Intention
- Rasche Erfassung der Wirksamkeit
- Reduktion der Anzahl erforderlicher Studienteilnehmer gegenüber dem Endpunkt Gesamtüberlebenszeit.
Schwächen
- Composite Endpoint: Alle zusammengesetzten Endpunkte haben ein höheres Verzerrungspotenzial durch unterschiedliche Gewichtung der eingeschlossenen Parameter.
- Notwendigkeit der transparenten Darstellung von Zensierung; der geschätzte Behandlungseffekt steigt mit dem Grad von Zensierungen und kann einen größeren Behandlungseffekt suggerieren.17
- Basierung auf technischen Endpunkten wie Bildgebung mit dem Risiko der Beeinflussung durch andere Therapie-induzierte Effekt wie Pseudo-Regression und Pseudo-Progression20 [de Groot] und/oder durch Laborergebnisse mit dem Risiko der Überlagerung von Therapie-Nebenwirkungen
- Sehr heterogenes Bild bei der Korrelation von PFS mit dem Gesamtüberleben bei unterschiedlichen Tumorentitäten.18
Der Einwand einer fehlenden Patientenrelevanz des primären Endpunktes PFS kann durch Kombination mit der Auswertung sekundärer Endpunkte wie Symptomatik, Lebensqualität (Patient-Reported-Outcome) und Toxizität kompensiert werden.
Morbidität – Remissionsrate
Bei aggressiv verlaufenden Malignomen ist eine Verlängerung der Überlebenszeit nur bei Erreichen einer Remission, in der Regel einer kompletten Remission, möglich. Das kann bei metastasierten oder primär systemischen Erkrankungen durch medikamentöse Therapie erzielt werden. Bei indolent verlaufenden Malignomen ist diese Korrelation nicht so eindeutig. Die Bewertung der Remissionsrate als primärer Endpunkt per se ist schwierig, weil seine Verwendung im Rahmen von Zulassungsstudien vor allem mit der Qualität der Studien zusammenhängt, siehe Abbildung 4.
Die Grafik zeigt, dass der primäre Endpunkt der Remissionsrate vor allem bei nicht-randomisierten Studien verwendet wurde. Deren Zahl war in den letzten Jahren gestiegen.
Stärken
- Direkte Abbildung der Wirksamkeit der jeweiligen Intervention
- Rasche Erfassung der Wirksamkeit
- Reduktion der Anzahl erforderlicher Studienteilnehmer gegenüber den Endpunkt Gesamtüberlebenszeit, krankheitsfreie und progressionsfreie Überlebenszeit.
Schwächen
- Basierung auf technischen Endpunkten wie Bildgebung mit dem Risiko der Beeinflussung durch andere Therapie-induzierte Effekt wie Pseudo-Regression und Pseudo-Progression [de Groot] und/oder durch Laborergebnisse mit dem Risiko der Überlagerung von Therapie-Nebenwirkungen
- Keine direkte Korrelation mit Patient-Reported-Outcome.
- Schwache Korrelation mit dem Gesamtüberleben.
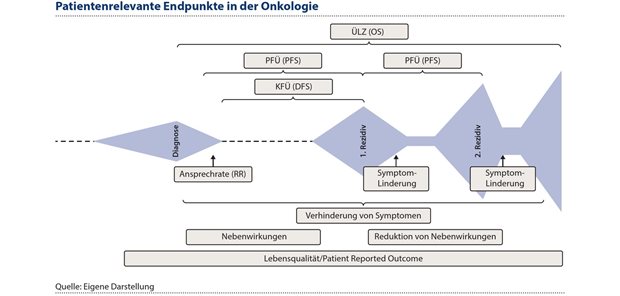
Abbildung 5: Die Onkologie, hier orientiert am Krankheitsverlauf, ist ein Beispiel für die erforderliche Vielfalt von Endpunkten, um die Vorteile eines neuen Medikaments zu erfassen und zu bewerten.
© DGHO
Morbidität – Symptomatik
Gerade im Bereich der Onkologie gibt es eine Vielzahl von sehr belastenden und die Lebensqualität einschränkenden Symptomen. Arzneimittel zur effektiven Symptomlinderung oder zur signifikanten Verlängerung der Zeit bis zum Auftreten belastender Symptome haben einen hohen Wert. Dennoch wird die Symptomatik nur selten als primärer Endpunkt definiert, konkret nur in 28 der 333 Verfahren. In Abbildung 1 sind diese Verfahren unter ‚andere‘ zusammengefasst. Eines dieser Ausnahmebeispiele ist die Stuhlfrequenz bei Pat. mit fortgeschrittenem Karzinoid bei der Bewertung von Telotristatethyl, weitere Beispiele sind die Symptomatik bei Pat. mit primärer Myelofibrose durch Fedratinib, Momelotinib oder Ruxolitinib.
Lebensqualität / Patient – Reported Outcome (PRO)
Parameter der Lebensqualität waren in keiner der onkologischen Studien primärer oder koprimärer Endpunkt.
Zusammenfassung und Ausblick
Die Onkologie ist ein gutes Beispiel für die erforderliche Vielfalt von Endpunkten in der Erfassung und Bewertung der Vorteile eines neuen Medikamentes. Eine Übersicht über patientenrelevante Endpunkte gibt Abbildung 5, orientiert am Krankheitsverlauf.
Neue Arzneimittel werden als Grundlage der Zulassung, der Nutzenbewertung als Basis der Preisbildung und in Leitlinien bewertet. Jedes Verfahren hat seine eigene Methodologie. Aus Sicht der Versorgung ist es wichtig, ‚Parallelwelten‘ mit Absolutheitsanspruch in der Bewertung von Arzneimitteln zu vermeiden. Sich widersprechende und/oder nicht nachvollziehbare Bewertungen verunsichern Patienten und Verordner.
Darüberhinaus ist es unerlässlich, Endpunkte auf ihre Wertigkeit zu überprüfen. Aus der Erfahrung von über 300 Verfahren zu neuen Arzneimitteln und Indikationen ergeben sich im Hinblick auf die HTA-Bewertung im Rahmen des AMNOG-Verfahrens für die Onkologie unter anderem folgende Herausforderungen:
- Anpassung der HTA-Kriterien an die verlängerten Überlebenszeiten, zum Beispiel durch Landmark-Analysen und/oder stärkere Integration weiterer Patienten-relevanter Endpunkte
- Entwicklung und Validierung einer Methodik zur gewichteten Bewertung unterschiedlicher Endpunkte unter Einbeziehung von Pat.
- Überprüfung der Kriterien für Nicht-Unterlegenheitsstudien.

© DGHO
Prof. Dr. Bernhard Wörmann ist Arzt für Innere Medizin, Hämatologie und Internistische Onkologie, und hat die Zusatzbezeichnung Palliativmedizin. Seit 2010 ist er Medizinischer Leiter der DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie, seit 2015 Vorsitzender der Kommission „Nutzenbewertung von Arzneimitteln“ der AWMF. Ärztlich ist er im Ambulanten Gesundheitszentrum der Charité und in der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie am Campus Virchow in Berlin tätig.
Literatur
1 Arbeitsgemeinschaft Gynäkologische Onkologie: Diagnostik und Therapie primärer und metastasierter Mammakarzinome: Endokrine und zielgerichtete Therapie metastasiertes Mammakarzinom. Status März 2024. AGO_2024D_26_Therapiealgorithmen_MASTER_schwarz (ago-online.de)
2 AWMF Leitlinie „Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms“. Registernummer 032-045OL, Juli 2021. https://go.sn.pub/flkeby
3 Griesinger F et al.: Nicht-kleinzelliges Lungenkarzinom (NSCLC). Leitlinien von DGHO, OeGHO, SGMO und SGH+SSH, Status Januar 2025. https://www.dgho-onkopedia.de/de/onkopedia/leitlinien/lungenkarzinom-nicht-kleinzellig-nsclc
4 Interdisziplinäre S3-Leitlinie: Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms, 020-007, November 2022, https://go.sn.pub/nzyfwn
5 Kolonkarzinom. Leitlinien von DGHO, OeGHO, SGMO und SGH+SSH, Status Januar 2024. https://go.sn.pub/mdg4um
6 https://go.sn.pub/i1v82z
7 Wolchok JD, Chiarion-Sileni V, Rutkowski P et al.: Final, 10-Year Outcomes with Nivolumab plus Ipilimumab in Advanced Melanoma. N Engl J Med 392:11-22, 2025. DOI: 10.1056/NEJMoa2407417
8 Wu YL, Dziadziuszko R, Ahn JS et al.: Alectinib in Resected ALK-Positive Non-Small-Cell Lung Cancer: N Engl J Med 390_1265-1276, 2024. DOI: 10.1056/NEJMoa2310532
9 Planchard D, Jänne PA, Cheng Y et al.: Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med 389:1935-1948, 2023. DOI: 10.1056/NEJMoa2306434
10 Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. N Engl J Med 376:917-927, 2017. DOI: 10.1056/NEJMoa1609324
11 Sonneveld P, Dimopoulos MA, Boccadoro M et al.: Daratumumab, Bortezomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 390:301-313, 2024. DOI: 10.1056/NEJMoa2312054
12 Wendtner C et al.: Chronische lymphatische Leukämie, September 2024. Chronische Lymphatische Leukämie (CLL) – Onkopedia
13 Nutzenbewertung nach § 35a SGB V (gefiltert) - Gemeinsamer Bundesausschuss
14 Allgemeine Methoden - Version 7.0
15 Nutzenbewertungsverfahren zum Wirkstoff Fruquintinib (Kolorektalkarzinom, vorbehandelte Patienten) - Gemeinsamer Bundesausschuss
16 European Medicines Agency: Guideline on the clinical evaluation of anticancer medicinal products, 18. November 2023. Anticancer GL Rev 6 adopted CHMP November 2023
17 Lengliné E, Baba J, de Boissieu P et al.: Composite event-free-survival as an endpoint in oncology drug evaluation: Review and guidance perspectives from the Haute Autorité de Santé (HAS). Eur J Cancer 204:114047, 2024. DOI: 10.1016/j.ejca.2024.114047
18 Belin L, Tan A, de Rycke Y, Dechartres A: Progression-free survival as a surrogate for overall survival in oncology trials: a methodological systematic review. Br J Cancer 122:1707-1714, 2020. DOI: 10.1038/s41416-020-0805-y




