Alzheimer offenbar bei Op übertragbar
Ein Grund mehr für Hirnchirurgen, ihre Instrumente zu sterilisieren: Alzheimer kann infektiös sein, zumindest wenn man Beta-Amyloid aus Alzheimer-Plaques ins Gehirn überträgt. Ob jedoch eine Therapie gegen Beta-Amyloid reicht, um die Krankheit zu verhindern, wurde auf dem DGN-Kongress von Experten bezweifelt.
Veröffentlicht: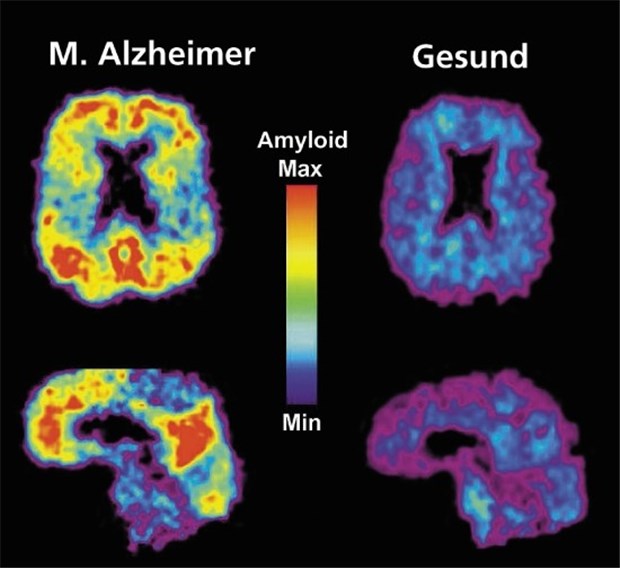
PiB-PET des Gehirns mit und ohne M. Alzheimer. Typische Amyloidablagerungen (gelb bis rot) werden sichtbar.
© Foto: University of Pittsburgh, PET Amyloid Imaging Group
Schon lange geistern Hypothesen durch die Literatur, nach denen ein Großteil der neurodegenerativen Erkrankungen - oder zumindest die dabei auftretenden, klumpen- und fibrillenförmigen Ablagerungen im Gehirn - durch fehlgefaltete Proteine verursacht werden, wie es derzeit für Prion-Erkrankungen gut dokumentiert ist. Nach dieser Hypothese zwingen einzelne Proteine mit einer schädlichen dreidimensionalen Konformation andere Proteine in eben diese zu kippen und lösen damit eine Kettenreaktion aus, an deren Ende unlösliche Aggregate stehen, die den Hirnzellen den Garaus machen.
Pathogenes Amyloid löst Kettenreaktion aus
Einen solchen Prozess hat ein Team um Professor Mathias Jucker vom Hertie-Institut für klinische Hirnforschung in Tübingen nun auch in einem Tiermodell für Alzheimer beobachtet: Injizierten die Forscher genetisch sensiblen Mäusen Hirnproben von Alzheimer-Patienten in den Hippocampus, dann entwickelten die Tiere ebenfalls rasch Amyloidplaques. Das gleiche geschah, wenn sie Amyloid-haltige Proben von anderen Mäusen ins Hirn der Versuchstiere brachten. Proben von gesunden Menschen oder gesunden Mäusen induzierten in den Versuchstieren dagegen keine Alzheimerpathologie, so Jucker in Nürnberg. Wurde Beta-Amyloid gezielt aus den Proben entfernt oder durch Antikörper blockiert, konnten die Versuchstiere ebenfalls keine Amyloidplaques entwickeln, was zeigt, so Jucker, dass es tatsächlich das Beta-Amyloid aus den Proben war, das eine Alzheimer-ähnliche Veränderung bei den Mäusen auslöste.
Eine Analogie zu BSE und Creutzfeldt-Jakob ergab sich auch, als die Forscher die induzierten Plaques genauer analysierten: Deren Struktur und Aufbau variierte zum Teil beträchtlich, je nachdem, woher die injizierte Probe stammte. Dies ließ sich am besten damit erklären, dass es ähnlich wie bei Prionen unterschiedliche "Stämme" von pathogenem Beta-Amyloid gab, die zu unterschiedlich anfärbbaren Plaques führten. Was an den Stämmen jedoch pathogen ist, konnten Jucker und sein Team nicht klären. Sie versuchten einen ähnlichen Effekt mit synthetischem Beta-Amyloid, konnten damit aber keine Plaques induzieren. Entweder hat das pathogene Amyloid noch Kofaktoren, oder es besitzt eine Konformation, die sich in vitro nicht erzeugen lässt, vermutet Jucker.
In einem Punkt konnte der Forscher jedoch beruhigen: Wurde pathogenes Beta-Amyloid oral, nasal oder intravenös appliziert, ließen sich die Versuchstiere nicht infizieren. Im Gegensatz zu Creutzfeldt-Jakob und BSE kann sich Alzheimer unter natürlichen Umständen also nicht auf andere Individuen oder gar Spezies ausbreiten, allenfalls durch Kontamination während einer Hirn-Op. Auch dies hat Jucker bei seinen Mäusen getestet. Ein kleiner implantierter Metalldraht, mit Beta-Amyloid verunreinigt, genügte, um die Kettenreaktion in Gang zu setzen.
Aggregiertes Amyloid so stabil wie Prion-Protein
Da heute jedoch die chirurgischen Instrumente gut sterilisiert werden müssen, sollte eine Übertragung ausgeschlossen sein. Von kochendem Wasser und aggressiven Enzymen allein lässt sich pathogenes Amyloid allerdings wenig beeindrucken. Es scheint ähnlich widerstandsfähig zu sein wie aggregiertes Prion-Protein. Sollte in der Vergangenheit tatsächlich einmal iatrogen Alzheimer übertragen worden sein, so vermutet Jucker äußerst lange Inkubationszeiten. Darauf deuteten Versuche mit Primaten, denen man bereits vor 20 Jahren Amyloid von Alzheimerkranker ins Gehirn injiziert hatte, und die viele Jahre später tatsächlich erkrankten.
Jucker vermutet, dass Prion-ähnliche Aggregationsprozesse auch bei Tau-Fibrillen und Lewy-Körperchen stattfinden und damit vielleicht einen grundlegenden Mechanismus für neurodegenerative Erkrankungen mit Inklusionen bilden.
Bleibt die Frage, was den Mechanismus auslöst, und wie er sich verhindern lässt. Hierbei sollte man nicht zu schnell von Mäusen auf Menschen zu schließen, warnte Dr. Monique Breteler von der Erasmus-Universität in Rotterdam in den Niederlanden. Zwar könne man im Tierversuch oft schöne Alzheimer-Phänotypen hervorrufen, doch dies reflektiere nicht unbedingt die komplexe Pathogenese bei Menschen. Breteler verwies etwa auf eine Arbeit, in der Autopsien von Alzheimer-Patienten und nicht demenzkranken alten Menschen gemacht wurden. Zwar fand man bei einem Großteil der Alzheimer-Patienten die typischen Amyloid-Ablagerungen, aber ebenso bei einem Großteil der Menschen ohne Demenz. Was die Alzheimer-Patienten von den Hirngesunden viel mehr unterschied als die Menge des Amyloids war die Tatsache, dass sie auch andere Pathologien zeigten, etwa Tauopathien, Lewy-Körperchen-Einschlüsse oder vaskuläre Defekte.
Gemischte Pathogenese bei Alzheimer?
Alzheimer scheine sich daher besser über eine gemischte Pathogenese erklären zu lassen als alleine über eine Beta-Amyloid-Hypothese. Vermutlich komme die Krankheit dann zum Ausbruch, wenn das Gehirn in multipler Weise geschädigt sei, und nicht nur durch Amyloid-Ablagerungen - in diesem Punkt gibt es also durchaus Übereinstimmungen zwischen Juckers Tiermodell-basierter Hypothese von neurodegenerativen Erkrankungen und Beobachtungen bei Menschen.
Die Konsequenzen wären allerdings beunruhigend: Ist Alzheimer tatsächlich ein polypathogener Prozess, dürfte es wohl sehr schwierig werden, neue zielgerichtete Medikamente zu entwickeln. Es sei denn, solche Arzneien könnten weitgehend unspezifisch jegliche Proteinverklumpung im Gehirn unterbinden, und nicht nur die von Beta-Amyloid.
Lesen Sie auch: Prävention bei Alzheimer nur schwer prüfbar Wenn Patienten nicht mehr zuhören