„ÄrzteTag“-Podcast
Wie lösen wir mit Registern die Evidenz-Krux bei seltenen Erkrankungen, Prof. Sarrazin?
Einer Arznei soll die Zulassung entzogen werden, weil sie in einer Studie gescheitert ist. Doch was, wenn die Studienbedingungen das Problem sind? Darüber sprechen wir am Beispiel der Primären biliären Cholangitis (PBC) mit Professor Christoph Sarrazin. Und wir sprechen über Lösungsansätze.
Veröffentlicht:
Ein Arzneimittel könnte die Zulassung verlieren, weil es in einer Phase-4-Studie keinen Vorteil gegenüber Placebo, dafür aber Sicherheitssignale zeigt. Was nachvollziehbar und wünschenswert aussieht, empört derzeit etliche Hepatologen. Konkret geht es um Obeticholsäure (OCA), das als Ocaliva zur Zweitlinien-Therapie bei Primärer biliärer Cholangitis (PBC) zugelassen ist.
Second-Line-Optionen sind bei PBC offenbar nötig: Denn etwa 20 bis 30 Prozent der Betroffenen sprechen nur ungenügend auf die Erstlinientherapie mit Ursodesoxycholsäure (UDCA, Urso) an, sagt Professor Christoph Sarrazin im „ÄrzteTag“-Podcast. Der Internist ist am St. Josefs-Hospital (JoHo) in Wiesbaden Chefarzt der Medizinischen Klinik II und leitet das dortige Leberzentrum. Er ist Vorstandsmitglied in der Deutschen Gesellschaft für Innere Medizin (DGIM) und Vorstandsvorsitzender der Deutschen Leberhilfe.
Vor Kurzem hatte die EU-Kommission entschieden, die Zulassung von OCA zu widerrufen. Vorangegangen war eine entsprechende Empfehlung des Humanarzneiausschusses CHMP der EU-Arzneibehörde EMA Ende Juni. Der Widerruf ist zwar bis auf Weiteres vom Gericht der Europäischen Union (EuG) ausgesetzt, der Fall wirft aber auch grundsätzliche Fragen auf.
Beim primären Komposit-Endpunkt versagt
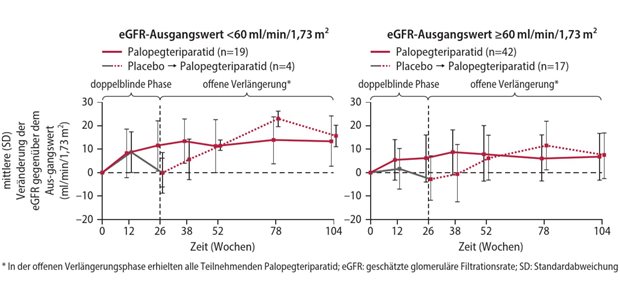
Die Phase-4-Studie – 747-302, auch COBALT genannt – war eine Bedingung für die damalige Ocaliva-Zulassung. Denn initial war für OCA die Evidenzlage dünn: Es wurde zugelassen, weil unter Therapie Bilirubin und Alkalische Phosphatase (AP) sanken, was als Therapieansprechen verstanden wurde. In der randomisierten, kontrollierten Postmarketingstudie COBALT sollte der Effekt auf klinische Outcomes gezeigt werden. Der primäre Endpunkt war ein Komposit aus Tod jeder Ursache, Lebertransplantation, MELD-Score ≥ 15, Hospitalisierung, Varizenblutung. hepatische Enzephalopathie, spontane bakterielle Peritonitis oder unkontrollierter Aszites.
Doch die Phase-4-Studie versagte: Gegenüber Placebo zeigte sich kein signifikanter Unterschied bei dem primären Endpunkt, jedoch gab es unter Verum Sicherheitssignale in Form von mehr Nebenwirkungen. Das Problem in der Studie: Probanden im Placebo-Arm haben aus Sorge, eine hilfreiche Therapie zu verpassen, entweder die Studie vorzeitig verlassen oder parallel eine OCA-Behandlung erhalten.
Damit wurden die Studienbedingungen für den Kontrollarm offenbar verzerrt. Und ein ähnliches Schicksal könnte einer anderen Zweitlinientherapie drohen: Erst kürzlich wurde Elafibranor bei PBC zugelassen, ein PPAR-Agonist (OCA ist ein FXR-Agonist). Auch dafür wurde eine Phase-4-Studie als Bedingung auferlegt.
Ethische Probleme – und mit Registern
Im Gespräch erklärt Sarrazin, dass er Patientinnen und Patienten verstehen kann, die trotz einer Studienteilnahme „zum letzten Strohhalm“ greifen. Zwar wünsche er sich harte Evidenz, möglichst aus RCT, nur sei es auch ethisch eine „Krux“, Menschen mit einer lebensbedrohlichen Erkrankung eine möglicherweise helfende Therapie zu verweigern. Erschwert wird das Problem bei seltenen Erkrankungen wie der PBC, da hier ohnehin die Zahl möglicher Probanden für Studien reduziert ist.
Als Lösungsoptionen schlägt Sarrazin unter anderem andere methodische Ansätze vor: Historische oder virtuelle Kontrollgruppen könnten eine Antwort auf das Placebo-Problem sein. Allerdings, gibt der Gastroenterologe und Hepatologe zu, treten dann andere Probleme auf, etwa Störfaktoren oder ungleiche Charakteristika der Studiengruppen.
Deswegen sieht er einen noch größeren Hebel in großen und unabhängig finanzierten Registern, aus denen nicht nur retrospektive Analysen gezogen, sondern Probanden für prospektive Studien randomisiert werden könnten. Dafür, so Sarrazin, müsste die Versorgungsforschung in Deutschland aber wesentlich besser ausgestattet und gefördert werden. (24:12 Minuten)










![Kommen die Kröpfe zurück nach Deutschland? Porträts: [M] Feldkamp; Luster | Hirn: grandeduc / stock.adobe.com](/Bilder/Portraets-M-Feldkamp-Luster-Hirn-grandeduc-stockadobecom-230510.jpg)