Kognitive und funktionelle Skala
Alzheimer: Lecanemab verbessert in Phase-III-Studie kognitive Beeinträchtigungen
Jahrelang gab es Rückschläge bei Therapiekandidaten gegen Morbus Alzheimer. Nun gibt es für einen neuen Antikörper positive Resultate.
Veröffentlicht:
Plaques beim M. Alzheimer (Symbol): Schaffen neue Antikörper die therapeutische Wende?
© Juan Gaertner/Shutterstock/obs
Tokio/Cambridge. Der neue Antikörper Lecanemab hat in der Phase-III-Studie „Clarity AD“ einen Vorteil beim Einsatz gegen eine frühe Alzheimer-Demenz gezeigt. Das teilten die beiden Hersteller Eisai und Biogen am Mittwoch mit. Die Daten sind noch nicht peer-reviewed publiziert, sollen aber Ende November beim Clinical Trials on Alzheimers Congress (CTAD) vorgestellt und in einer Fachzeitschrift veröffentlicht werden.
Lecanemab ist ein Antikörper gegen Beta-Amyloid-Protofibrillen. In „Clarity AD“ wurde er gegen Placebo an 1795 Probanden mit einer leichten kognitiven Beeinträchtigung (MCI) aufgrund eines Morbus‘ Alzheimer bzw. eines frühen Alzheimers untersucht. Amyloid-Plaques mussten nachgewiesen sein.
Effekt schon nach einem halben Jahr
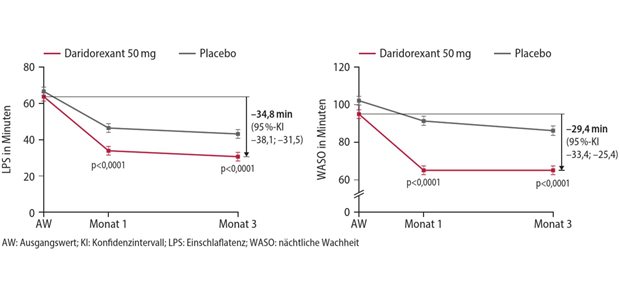
Die Teilnehmer wurden 1:1 auf die Prüfsubstanz (BAN2401) oder Placebo aufgeteilt. Unter Verum erhielten die Probanden eine Lecanemab-Dosis von 10 mg/kg Körpergewicht alle zwei Wochen. Primärer Endpunkt ist die Verbesserung in der Clinical Dementia Rating Scale-sum of the boxes (CDR-SB) gegenüber Studienbeginn.
Unter Lecanemab verbesserte sich den Angaben zufolge die CDR-SB im Vergleich zu Placebo nach 18 Monaten um relative 27 Prozent. Der Effekt sei bereits nach sechs Monaten „hochgradig statistisch signifikant“ gewesen, so die Hersteller. Auch sollen die Amyloidspiegel im Gehirn signifikant niedriger gewesen sein, gemessen mit Amyloid-PET, sowie zahlreiche weitere Scores.
Nebenwirkungen deutlich häufiger
Allerdings wurde – erwartbar – häufiger unter Verum eine Amyloid-related Imaging Abnormality (ARIA-E) festgestellt: 12,5 vs. 1,7 Prozent. Die Inzidenz der symptomatischen ARIA-E lag bei 2,8 vs. 0,0 Prozent). Die ARIA-H-Rate (bspw. zerebrale Blutungen) betrug 17,0 Prozent in der Lecanemab-Gruppe und 8,7 Prozent bei Placebo. Die Inzidenz der symptomatischen ARIA-H lag bei 0,7 bzw. 0,2 Prozent. Keinen signifikanten Unterschied gab es bei der isolierten ARIA-H (ohne Nachweis einer ARIA-E): 8,8 vs. 7,6 Prozent.
Beide Hersteller wollen diese Daten nun in den USA, Europa und Japan für Zulassungsanträge einreichen. (nös)