EU-Zulassung empfohlen
Positives Signal für Ozanimod als MS-Arznei
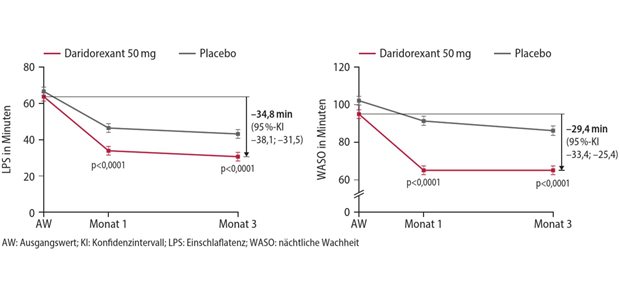
München. Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat die EU-Zulassung für Ozanimod (Zeposia®) zur Behandlung Erwachsener mit schubförmig remittierender Multipler Sklerose (relapsing remitting multiple sclerosis; RRMS)mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung, empfohlen. Basis der Zulassungsempfehlung sind die randomisierten, aktiv kontrollierten Phase-III-Studien SUNBEAM™ und RADIANCE™ Teil B, in die mehr als 2600 Patienten in 150 Prüfzentren in über 20 Ländern eingeschlossen wurden.
Ozanimod ist ein oral verabreichter Sphingosin-1-Phosphat(S1P)-Rezeptormodulator, der selektiv an die S1P-Rezeptorsubtypen 1 und 5 bindet. Ozanimod führt zur Lymphozytenretention in lymphoiden Geweben. Der Mechanismus, über den Ozanimod seine therapeutischen Wirkungen bei MS entfaltet, ist bisher unbekannt, könnte aber eine Verringerung der Lymphozytenmigration in das ZNS beinhalten. (eb)
Quelle: Mitteilung von Celgene, ein Unternehmen von Bristol Myers Squibb