Der Feind meines Feindes
Revival der Phagen: Neue alte Menschenfreunde?
Bereits vor über 100 Jahren entdeckt, sind sie heute, da die goldene Antibiotika-Ära Patina angesetzt hat, erneut Hoffnungsträger vieler Infektiologen: Bakteriophagen. Der Beginn eines Revivals.
Veröffentlicht:
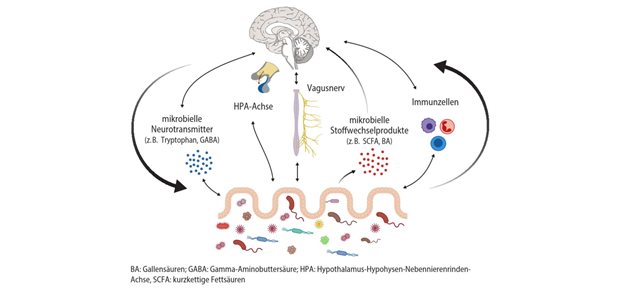
Darstellung einer Bakteriophage, die ein Bakterium attackiert.
© Corona Borealis / stock.adobe.com
Sie erwecken den Eindruck, die neuen Stars der Infektiologie zu werden. Dabei sind sie bereits Altstars: Bakteriophagen. Ihre Eigenschaften werden, ein Jahrhundert nach ihrer Entdeckung, wieder geschätzt angesichts globaler Antibiotika-Multiresistenzen bakterieller Erreger. Das unter anderem auch, weil es dank moderner Technologien möglich geworden ist, die antibakteriellen Qualitäten von Bakteriophagen auf ein Niveau zu heben, das man als „übernatürlich“ bezeichnen könnte.
ESKAPE ist das Akronym für eine Gruppe hochvirulenter Bakterien, die die Weltgesundheitsorganisation als vorrangig für die Entwicklung neuer antimikrobieller Medikamente eingestuft hat, weil sie sich häufig dem antibiotischen Zugriff entziehen: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp. Einige davon gehören zu den häufigsten Erregern von Harnwegsinfektionen: Klebsiellen, Enterococcus spp. sowie Escherichia coli. Und weil Harnwegsinfektionen (HWI) mit weltweit jährlich schätzungsweise bis zu 400 Millionen Erkrankungen zu den häufigsten Gründen gehören, eine Antibiotikatherapie zu beginnen und damit maßgebliche Resistenztreiber sind, konzentrieren sich inzwischen viele Forschergruppen weltweit auf deren natürliche und ubiquitär vorkommenden Feinde, eben die Bakteriophagen.
Ausgeprägte Spezifität
Bakteriophagen sind auf Bakterien spezialisierte Viren. Genutzt als therapeutisches Werkzeug, bieten sie gegenüber Antibiotika mehrere Vorteile: Geringe Umweltbelastung, die Mikrobiota bleibt erhalten, die Isolierung ist einfach und kostengünstig, Kreuzresistenzen gibt es nicht und die Verträglichkeit der therapeutischen Anwendung ist nach bisherigen Erkenntnissen gut. Vor allem infizieren Phagen auch jene Bakterien, die bereits antibiotikaresistent sind. Zum anderen konnte in einigen Fällen bereits beobachtet werden, dass sie die Empfindlichkeit von Bakterien gegenüber Antibiotika erhöhen. Die ausgeprägte Spezifität von Phagen ist jedoch zugleich ein Problem: Phagen binden an spezifische Rezeptoren auf der Oberfläche ihrer bakteriellen Opfer, aber der Wirtsbereich ist teils sehr eng. Dann können zum Beispiel keine verschiedenen Stämme derselben Bakterienart befallen werden. Und: Phagen hätten „kein Interesse“ daran, ihren Wirt vollständig zu eliminieren, wie es Dr. Samuel Kilcher, Forscher an der ETH Zürich, formuliert hat. Außerdem wird angenommen, dass Bakterien auch gegen hochspezialisierte Phagen resistent werden können.
Obwohl etwa in der ehemaligen Sowjetunion Phagen kontinuierlich zur Behandlung etwa von Magen-Darm-Infektionen oder bei Gasbrand eingesetzt worden sind und obwohl es auch in Polen eine lange Geschichte der Phagenforschung gibt, gilt die Phagentherapie bislang noch als Erfahrungsmedizin, zumindest in westlichen Industriestaaten. Randomisierte kontrollierte klinische Studien sind rar. Allerdings hat in der vergangenen Dekade die Erforschung von Bakteriophagen deutlich an Fahrt aufgenommen, zu erkennen an der Vervierfachung der jährlichen Publikationen zu dem Thema.
So hat sich zum Beispiel eine Arbeitsgruppe aus Portugal auf einen Phagen konzentriert, der in der Lage ist, einen Carbapenemase-produzierenden Klebsiella-pneumoniae-Stamm zu infizieren. Bei In-vitro-Tests war der Phage KP1LMA in der Lage, die Klebsiellen in menschlichem Urin zu inaktivieren. KP1LMA sei sicher in der Anwendung, da das Virus rein lytische Eigenschaften habe und keine virulenten Gene oder Gene für Antibiotikaresistenz enthalte.
„Sein enger Wirtsbereich lässt jedoch vermuten, dass dieser Phage nicht in der Lage ist, einen anderen Stamm zu infizieren“, berichten João Duarte und Carolina Máximo von der Universität in Aveiro, Portugal, und Kollegen (Antibiotics 2024; 13:195). Der Phage sei deshalb vor allem für experimentelle Verfahren geeignet, mit denen neue Phagen mit breitem Wirtsspektrum erzeugt werden könnten. Phagencocktails könnten dazu beitragen, das Problem der bakteriellen Phagenresistenz zu lösen, so die Wissenschaftler. Dafür müssten Phagen mit unterschiedlichen Infektionsmechanismen genutzt werden.
Positives Studienreview
In einem Review von 55 Fachartikeln zur Erforschung von Bakteriophagen an Tieren und Menschen waren in 78 Prozent der Studien biologische und klinische Verbesserungen einer HWI festgestellt worden: Die bakterielle Last nahm ab, klinische Symptome verbesserten sich, die Häufigkeit jährlicher HWI-Rezidive nahm ab, berichten Amany Al-Anany von der McMaster University in Hamilton, Kanada, und ihre Kollegen (Phage (New Rochelle) 2023; 4(3):112–127). Dabei ist zu berücksichtigen, dass Phagen häufig in Kombination mit anderen Therapien wie Antibiotika appliziert worden waren.
Eingebracht werden die Phagen sehr verschieden: via Instillation, Blaseninjektion, Blasenspülung oder -lavage. Die Dosierungsfrequenz und Dauer der Therapie war in den Studien ebenfalls sehr unterschiedlich. Es wurden einzelne Phagen wie auch Multi-Phagen-Cocktails verwendet. Standardisierte Behandlungsprotokolle gibt es bislang nicht. „Eine mikrobiologische Heilung wurde in den meisten Fällen etwa zwei Wochen nach Beginn der Therapie festgestellt“, so Al-Anany und Koautoren. Allerdings war nicht in allen randomisiert kontrollierten Studien eine Effektivität festzustellen.
Die Verträglichkeit scheint gut zu sein, lautet ein weiteres Ergebnis des Literaturreviews. Unerwünschte Wirkungen sind offenbar selten und waren vermutlich oft auf die Begleittherapien zurückzuführen. Seltsamerweise war jedoch in fast 60 Prozent der ausgewerteten Studien gar keine Angabe dazu zu finden, ob Nebenwirkungen aufgetreten waren oder nicht. Wünschenswert sind also standardisierte Therapie-, Überwachungs- und Berichtsprotokolle. Diese Informationen sollten idealerweise in ein Phagenregister einfließen, so die kanadischen Wissenschaftler und Wissenschaftlerinnen.
Leuchtende Phagen
Wenn also Wildtyp-Bakteriophagen so hoch spezialisiert sind, kommt es darauf an, genau zu wissen, welche bakteriellen Erreger den Harnwegsinfekt ausgelöst haben. Forschende von der ETH Zürich haben einen diagnostischen Schnelltest auf E. coli, Enterococcus spp. und Klebsiella spp. entwickelt, also die am häufigsten bei HWI vorkommenden Erreger. Dazu wurden zwei virulente Phagen so verändert, dass bei Bakteriurie eine Biolumineszenz induziert wird (Nature Communications 2023; 14:4336). Dies würde es schon einmal erlauben, zielgerichtet antibiotisch zu behandeln – und zwar innerhalb weniger Stunden, während die übliche mikrobiologische Diagnostik bekanntlich Tage braucht.
Ein weiterer Vorteil des Tests: Es lässt sich leicht ermitteln, welche Patienten besonders von einer maßgeschneiderten Phagentherapie profitieren würden: je stärker das Lichtsignal, desto eher. Die Arbeitsgruppe hat daher Phagen genetisch so modifiziert, dass sie die krankheitserregenden Bakterien noch effizienter als zuvor zerstören können. Sie haben in die Phagen die genetische Information für synthetische antimikrobielle Peptide und spezifische Zellwandhydrolasen eingebaut. Das bakterielle Opfer muss diese Killermoleküle selbst produzieren, bevor es daran zugrunde geht. Das ist auch deshalb wichtig, weil die Bakterien durchaus Abwehrmechanismen gegen Phagen entwickeln können, die Produktion extrazellulärer Matrix zum Beispiel oder eine reduzierte Expression von Phagenrezeptoren.
Die gentechnisch optimierten Phagen werden als heterologe Effektor-Phagen-Therapeutika (HEPTs) bezeichnet. HEPTs oder HEPT-Cocktails sollen nach Angaben der Schweizer Forscher die gattungsübergreifende Bekämpfung bakterieller Krankheitserreger ermöglichen – die genomische Plastizität der Phagen macht’s möglich. Außer mit einer antimikrobiellen Verstärkung könnten HEPTs auch mit Immunmodulatoren oder Biofilm-auflösenden Enzymen versehen werden. Dieser personalisierte Behandlungsansatz könne mit einer minimalen Zahl von Phagenbestandteilen erzielt werden, was den Aufwand, die Kosten und die Komplexität der Behandlung reduziere, heißt es. Und das selbstverständlich nicht nur bei HWI, sondern auch bei anderen Infektionskrankheiten.
KI-Support für Phagen-Therapie
Künstliche Intelligenz (KI) kann womöglich ebenfalls bei der künftigen Phagenselektion zur antimikrobiellen Therapie helfen: Marianne Keith vom The Roslin Institute an der Universität in Edinburgh und Kollegen haben einen Genomik-gestützten Ansatz zur Vorhersage des idealen Phagencocktails mithilfe maschinellen Lernens entwickelt, vorerst für E.-coli-Infektionen. Die KI wurde anhand tausender Wechselwirkungen zwischen einer Gruppe von Phagen und sequenzierten Bakterienisolaten trainiert und die Aktivität von 31 Phagen an 314 Bakterienisolaten in künstlichem Urin gemessen (PNAS 2024;121: e2313574121).
Das Potenzial natürlich vorkommender und genetisch optimierter Phagen wird derzeit weltweit in vielen klinischen Studien untersucht. Obgleich mit Bakteriophagen-basierten Therapien in manchen Regionen Europas bereits jahrzehntelange Erfahrungen bestehen, schätzen Wissenschaftlerinnen und Wissenschaftler, dass es bis zur routinemäßigen Anwendung in den westlichen Industriestaaten noch ein Stück Weg sein wird.
Ein wichtiger Schritt hin zu mehr Evidenz wird die Standardisierung der Phagen-Herstellung sein sowie das Schaffen rechtlicher und logistischer Voraussetzungen. Dazu hat die Deutsche Gesellschaft für Infektiologie die S2k-Leitlinie „Personalisierte Bakteriophagen-Therapie in Deutschland“ angemeldet. Die Empfehlungen nationaler und internationaler Experten sollen bis zum Sommer 2024 fertiggestellt sein.