Lernen von Legionellen
Forscher entwickeln Antibiotika-Alternative
Die zunehmende Bildung von Antibiotika-Resistenzen ist eines der drängendsten medizinischen Probleme. Frankfurter Forscher haben ein neues Konzept entwickelt, um die konventionelle Therapie zu unterstützen: Sie greifen in den Wirkmechanismus von Bakterien ein, ohne diese direkt anzugreifen.
Veröffentlicht: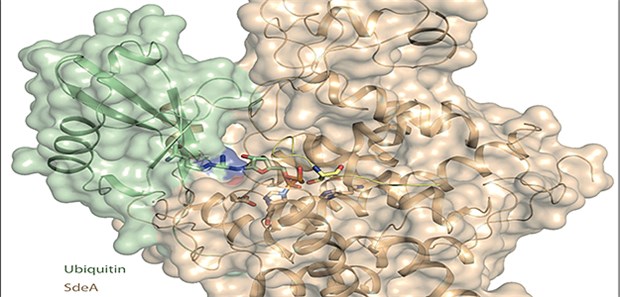
Der Trick: Das toxische SdeA (braun) bindet Ubiquitin (grün) an sich.
© Nature/Kalayil et al, Mai 2018
FRANKFURT. Forscher der Goethe-Universität Frankfurt haben ein neues Konzept zur Bekämpfung von Bakterien entwickelt, ohne auf Antibiotika zurückgreifen zu müssen. Ihre Methode basiert nicht auf das direkte Ausschalten der Bakterien, sondern in dem Unschädlichmachen seiner hergestellten Enzyme, schreiben die Wissenschaftler in der Online-Ausgabe von "Nature" (doi: DOI 10.1038/s41586-018-0146-7).
Das Team hatte bereits herausgefunden, welche enzymatischen Wege Legionellen nehmen, um eine Wirtszelle umzuprogrammieren (doi: 10.1038/s41586-018-0147-6). Die Frankfurter hatten gemeinsam mit Kollegen entdeckt, dass die Bakterien mittels eines Enzyms das Ubiquitin-System im Wirt manipulieren, so eine zugehörige Mitteilung.
Überlicherweise bindet körpereigenen Ubiqutin in Eukaryoten an fehlgebildete Moleküle, die dann im Proteasom abbaut werden. Der Prozess heißt Ubiqitinierung – die Forscher bezeichnen ihn als "Todeskuss" für nicht mehr benötigte Proteine.
Lernen von Legionellen
Außerdem verändert das Legionellen-Enzym körpereigene Ubiquitin-Moleküle, wie die Frankfurter vorletztes Jahr herausgefunden haben. Dadurch hemmt das Bakterium zahlreiche körpereigene Prozesse: Nicht nur die Zerstörung der Ubiquitin-behafteten Proteine wird verhindert, das Enzym erhält die Mitochondrienfunktion und damit die Energieversorgung der Legionellen. Zudem legt es die Weiterleitung von Entzündungssignalen lahm.
Auf diese Art kapert der Keim zelluläre Wirtsprozesse. "Wir gehen davon aus, dass die Legionellen dadurch entscheidende Vorteile haben", sagt Dr. Kerstin Koch auf Nachfrage der "Ärzte der Zeitung".
Manipulation auf Proteinebene
Wie funktioniert die Aushebelung des Schutzmechanismus auf Molekülebene? Das Team entlarvte das toxische SdeA von Legionellen als jenes Enzym, das das regulatorische Protein Ubiquitin an die Wirtszelle anheftet.
Die Wissenschaftler haben auch die Struktur von SdeA analysiert. "Durch Aufklärung der grundlegenden Struktur konnten wir nun den Beweis erbringen, dass diese bakteriellen Enzyme gezielt angreifbar sind", so Prof. Ivan Dikic in einer Mitteilung. Das toxische Enzym spiele wohl auch bei anderen Keimen eine Rolle, womit diese Kontrolle über den Wirtskörper erlangen.
Neue Therapieoptionen?
Die Frankfurter Wissenschaftler haben nach eigenen Angaben bereits einen Inhibitor entwickelt, der das toxische SdeA hemmt. Diese Proteinhemmung könnte in Zukunft eine Antibiotika-Therapie unterstützen: "Wir glauben, dass wir die konventionelle Antibiotika-Therapie ergänzen können, indem wir bakterielle Effektorproteine gezielt mit rational entwickelten Wirkstoffen ausschalten", führt Dikic weiter aus.
Ob dies zu einem geringeren Einsatz von Antibiotika führt – und damit Resistenzen vermeidet –, bleibt noch offen.