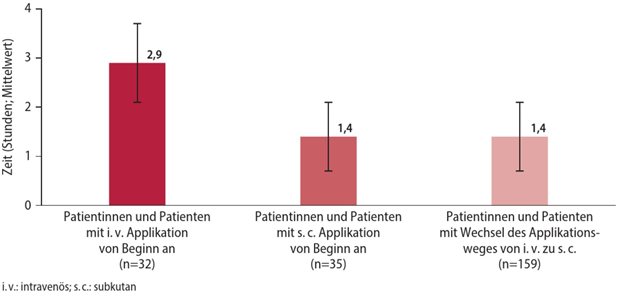
BioNTech/Pfizer
Neue Daten zu Omikron-Impfstoffen und Unmut über Zulassungspraxis
BioNTech und Pfizer haben Daten zu neuen Vakzinen gemeldet, die an den Omikron-Subtypen BA.1 angepasst sind. BioNTech-Chef Ugur Sahin plädiert wegen des rasch mutierenden Virus für schnellere Zulassungsprozesse.
Veröffentlicht:Mainz. Zwei Corona-Impfstoffe von Pfizer/BioNTech, die auf eine Omikron-Sublinie zugeschnitten sind, haben laut den Herstellern in einer klinischen Studie gute Ergebnisse erzielt. Dabei ging es um die Verwendung der Vakzine als Booster, wie die Unternehmen am Samstag mitteilten.
Die neuen Vakzine sind auf die in Deutschland nicht mehr kursierende Omikron-Sublinie BA.1 angepasst sind. Einer der nun getesteten Impfstoffe besteht nur aus auf BA.1 angepassten Komponenten, der andere ist ein Mix aus dem angepassten und dem bestehenden Mittel. Probanden, die als Booster einen angepassten Impfstoff erhalten hatten, hatten danach „deutlich höhere neutralisierende Antikörperreaktionen“ gegen die Omikron-Sublinie BA.1 als beim bisherigen BioNTech/Pfizer-Impfstoff, heißt es in der Mitteilung. Insgesamt machten an der Studie 1234 Teilnehmer im Alter ab 56 Jahren mit.
Wirksamkeit auch gegen BA.4 und BA.5, „wenn auch in geringerem Umfang“
Eine BioNTech-Sprecherin sagte auf Anfrage, noch seien keine Daten veröffentlicht, wie die angepassten Impfstoffe gegen die aktuell vorkommenden Sublinien wie BA.4 und BA.5 im Vergleich zur bestehenden Vakzine abschneiden. Laut Mitteilung sei aber in vorläufigen Laborstudien gezeigt worden, dass beide angepassten Impfstoffe gegen Viren der Sublinien BA.4 und BA.5 wirken, wenn auch in geringerem Umfang als bei BA.1. „Pfizer und BioNTech werden in den kommenden Wochen weitere Studiendaten zu den Omikron-Varianten BA.4/BA.5 erheben.“
Die Daten werden unter anderem der EU-Arzneimittelbehörde EMA zu Verfügung gestellt, bei der bereits ein Prüfverfahren läuft. Die EMA prüft zudem einen angepassten Impfstoff des US-Herstellers Moderna. Bisher ist noch kein Impfstoff in der EU zugelassen, der auch auf Varianten des Corona-Virus zielt.
PEI-Chef Klaus Cichutek: „Eine Notlage liegt momentan nicht vor“
Die Zulassung eines solchen Mittels wird frühestens im September erwartet, auch weil die Hersteller noch klinische Studiendaten vorlegen müssen. Nun gibt es Diskussionen, ob diese Studien wirklich notwendig sind. Die Argumentation: Mit weniger Vorgaben ginge die Zulassung schneller, und die Gefahr wäre geringer, dass das Virus bei Impfstart bereits weiter mutiert ist, so dass es der Impfwirkung einfacher entkommen kann. BioNTech-Chef Professor Ugur Sahin sprach sich kürzlich in der „Financial Times“ für ein wesentlich schnelleres Verfahren aus, das keine zusätzlichen klinischen Studien erfordert – ähnlich wie beim jährlich angepassten Grippe-Impfstoff. Das könne bis zu vier Monate Zeit sparen.
Der Präsident des in Deutschland für Impfstoffe zuständigen Paul-Ehrlich-Instituts (PEI), Professor Klaus Cichutek, sieht das anders. „Wenn wir uns in Ruhe vorbereiten auf die Herbstwelle, gibt es überhaupt keinen Grund, auf die entsprechenden klinischen Daten beim Menschen zu verzichten“, sagte er der „Welt am Sonntag“. Zwar könne man die Zulassungspraxis in einer Notlage anpassen, die läge aber momentan nicht vor. (dpa)