Antikörperforschung
Paul Ehrlich-Preis für deutschen Immunologen
Bevor Antikörper gebildet werden, müssen die mit dieser Aufgabe betrauten Immunzellen aktiviert werden. Professor Michael Reth aus Freiburg hat wichtige Schritte des Prozesses entschlüsselt und erhält dafür den Paul Ehrlich- und Ludwig Darmstaedter-Preis 2014.
Veröffentlicht:Professor Michael Reth

© Michael Reth privat
Tätigkeit: Professor für Molekulare Immunologie an der Universität Freiburg. Arbeitsgruppenleiter am Max-Planck-Institut für Immunbiologie und Epigenetik und Sprecher des Exzellenzclusters BIOSS, Zentrum für Biologische Signalstudien in Freiburg.
Werdegang: Reth wurde 1950 in Düsseldorf geboren. Er hat in Köln Biologie studiert und am Institut für Genetik der Universität Köln promoviert. Danach Forschungsaufenthalt an der Columbia Universität in New York. Seit 1989 am MPI für Immunbiologie in Freiburg..
FRANKFURT/MAIN. Der mit 100.000 Euro dotierte Paul Ehrlich- und Ludwig Darmstaedter-Preis geht in diesem Jahr an Michael Reth, Professor für Molekulare Immunologie am Institut für Biologie III der Albert-Ludwigs-Universität Freiburg. Reth wird für seine herausragenden Forschungsleistungen auf dem Gebiet der Antikörperforschung ausgezeichnet.
"Michael Reth hat gezeigt, wie die B-Zellen des Immunsystems aktiviert und zur Produktion von Antikörpern veranlasst werden", begründet der Stiftungsrat der Paul Ehrlich-Stiftung seine Entscheidung. Damit hat Reth geholfen, die molekularen Grundlagen von Paul Ehrlichs berühmter Seitenkettentheorie zu entschlüsseln.
Molekulare Details aufgedeckt
Der Preis wurde am 14. März (Ehrlichs 160. Geburtstag) von Professor Harald zur Hausen in der Frankfurter Paulskirche überreicht. Er gehört zu den renommiertesten Auszeichnungen, die in Deutschland auf dem Gebiet der Medizin vergeben werden, und wird seit 1952 verliehen.
Die mit der Produktion von Antikörpern betrauten B-Zellen werden über den sogenannten Antigenrezeptor aktiviert. Dieser besteht aus einem zur Schau gestellten Antikörper und aus zwei Proteinen, die Reth entdeckt hat.
Die Proteine funktionieren wie Herolde. Sie melden der B-Zelle, wenn draußen ein passendes Antigen an den Antikörperteil des Antigenrezeptors angedockt hat, und helfen dabei, das Signal über weitere Zwischenstufen an die Schaltzentralen der Zelle weiterzuleiten.
Reth hat viele molekulare Details dieser Signalkette aufgeklärt. Fehler in dieser Signalkette können zu Leukämien führen.
Neue Erkenntnisse zu Antigenrezeptoren gewonnen
Reth hat auch mit einem Modell zur B-Zell-Aktivierung aufgeräumt, das sich allerdings in vielen Lehrbüchern noch hartnäckig hält.
Jede B-Zelle verfügt über 120.000 Antigenrezeptoren. Diese liegen nicht einzeln auf der Oberfläche vor, sondern in Gruppen, wie der Preisträger und seine Arbeitsgruppe zeigen konnten.
"Die Bindung eines Antigens destabilisiert die Gruppe", erklärt Reth. "Sie zerfällt daraufhin in einzelne Antigenrezeptoren. Diese Dissoziation ist der Anstoß zur Aktivierung der B-Zelle".
Das von Reth widerlegte Modell geht vom Gegenteil aus. Demnach würde der Antigenrezeptor dadurch aktiviert werden, indem sich einzelne Rezeptoren zu einer Gruppe zusammenfänden.
Weil man nur das wirklich verstanden hat, was man aus Einzelteilen auch wieder zusammensetzen kann, geht Reth den Weg der synthetischen Biologie und baut den Antigenrezeptor der Säugetiere in der Taufliege nach. Als nächstes will er mehr über die Proteinlandschaft auf der Oberfläche der B-Zelle wissen.
"Wir haben herausgefunden, dass im 10 bis 200 Nanometer Bereich die Membranproteine viel geordneter vorliegen als bisher angenommen", sagt Reth. "Sie verteilen sich nicht wahllos auf der Oberfläche der B-Zelle, sondern sind in Proteininseln organisiert.
Die Aktivierung des Antigenrezeptors könnte auch über die Organisation dieser Proteininseln kontrolliert werden". Von diesem Ausflug in die Nanowelt verspricht sich Reth viele neue Erkenntnisse über Immunzellen. (eb)
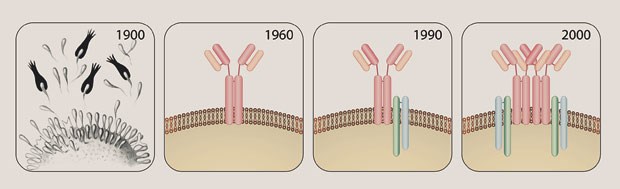
Geschichte des Antigenrezeptors: Am Anfang steht Paul Ehrlichs Seitenkettentheorie (links). Seit 1960 weiß man, dass der Antigenrezeptor einen in der Membran verankerten Antikörper enthält. Michael Reth entdeckte 1990 die beiden Signalmoleküle dieses Rezeptors, Iga und Igb. Zehn Jahre später zeigte er, dass die Antigenrezeptoren nicht einzeln in der Membran angeordnet sind, sondern in Gruppen.
© Michael Reth, Universität Freiburg
Lesen Sie dazu auch: Forschung zu Zellsensoren: Nachwuchspreis für Dr. Ablasser





