Schutz vor COVID-19
Corona-Impfung für Kinder erst 2022?
Schwere COVID-19 Verläufe sind bei Kindern selten. Dennoch haben einige Hersteller begonnen, ihre Corona-Impfstoffe an Minderjährigen zu testen – auch um Erwachsene zu schützen. Der Einsatz wird wohl noch dauern.
Veröffentlicht: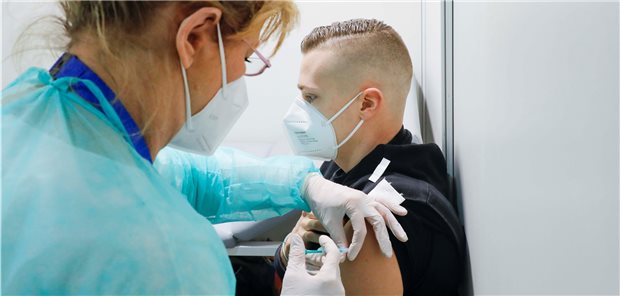
Wann kommt die Corona-Impfung bei Jugendlichen und Kindern? Bislang ist erst ein Impfstoff ab 16 Jahren überhaupt zugelassen.
© picture alliance / Jochen Eckel
Langen/Mainz. Bislang werden vorrangig die Ältesten gegen COVID-19 geimpft, aber mit weiteren Impfstofflieferungen soll dann auch andere Altersgruppe zusehends geimpft werden. Bis September – so die Aussage der Bundeskanzlerin – soll jeder Bundesbürger ein Impfangebot haben. Doch was ist mit den Kindern? Ein einziger Impfstoff ist bisher ab 16 Jahren zugelassen, alle anderen nur für Erwachsene. Erst wenige Hersteller haben mit Studien an Minderjährigen begonnen.
Der Direktor des Zentrums für Kinder- und Jugendmedizin der Universität Mainz, Professor Fred Zepp rechnet „frühestens Ende des Jahres, eher Anfang nächsten Jahres damit“, dass Kinder in Deutschland geimpft werden könnten. „Der Prüfaufwand ist viel höher als bei Erwachsenen“, sagt Zepp, der auch Mitglied der Ständigen Impfkommission (STIKO) ist. Kinder gegen COVID-19 zu impfen, sei zunächst einmal „fremdnützig“, so Zepp. Denn diese erkrankten deutlich seltener schwer. „Wir würden Kinder also vor allem impfen, um Ältere zu schützen.“ Daher müsse hinterfragt werden, ob das abgesehen von Kindern mit besonderen Infektionsrisiken ethisch vertretbar sei. Zudem sei auch ohne Durchimpfung von
Kinder vermutlich die angestrebte Herdenimmunität zu erreichen – einfach, indem sie sich infizierten.
Auch das Robert Koch-Institut (RKI) verweist: „Vor der klinischen Prüfung an Kindern muss sichergestellt sein, dass in den Studien bei Erwachsenen keine schwerwiegenden Nebenwirkungen aufgetreten sind“. Kinder seien schon allein aus ethischen Gründen nicht für frühe Tests vorgesehen.
Stand der Studien mit Corona-Vakzine bei Kindern
Der Verband Forschender Arzneimittelhersteller (vfa) hat den Stand (6.2.) bei den Impfstoffherstellern zusammengetragen:
- BionTech/Pfizer (BNT162b2b): Die Zulassung des Impfstoffs umfasst bereits heute Jugendliche ab 16 Jahre. Im Herbst 2020 wurden laut vfa noch zwei Studienarme mit Teilnehmern von 12 bis unter 16 Jahren zur Studie hinzugefügt. Die Jugendlichen erhalten im Rahmen der Studie die gleiche Dosierung wie die Erwachsenen. Geplant ist es, auch Kinder zwischen 0 und 15 Jahren zu testen.
- Moderna (mRNA-1273) hat im vergangenen Dezember damit begonnen, minderjährige Probanden zu suchen. Teilnehmen sollen nach Unternehmensangaben 3000 Kinder zwischen 12 und 17 Jahren. Bisher sind nur US-Kliniken an der „TeenCove“-Studie beteiligt. Zwei Drittel der Teilnehmer bekommen den Impfstoff, der Rest ein Placebo. Die Jugendlichen werden im Abstand von einem Monat zwei Mal geimpft und werden danach 13 Monate lang begleitet. Mindestens sechs Mal müssen sie in die Klinik, dazu kommen Telefonate und Rückmeldungen per App. Erwarteter Abschluss der Studie: Mitte 2022.
- AstraZeneca (AZD1222) hat noch nicht mit pädiatrischen Studien begonnen. Man plane aber, „die Studien in einem neuen Protokoll für die Altersgruppe der 6- bis 18-Jährigen fortzusetzen“, heißt es bei dem britisch-schwedischen Hersteller. „Diese sollen in den kommenden Monaten beginnen.“
- Janssen-Cilag (Ad26.COV2.S) führt mit seinem (noch icht zugelassenen) Impfstoff Ad26.COV2.S seit August 2020 eine Phase II-Studie mit Teilnehmern ab 12 Jahren durch. Bislang sind noch keine Ergebnisse bekannt geworden.
- Ansonsten gibt es ein paar Projekte von chinesischen sowie einer indischen und einer vietnamesischen Firma, bei deren Studien auch Minderjährige mitwirken. Es ist jedoch nicht mit einem Zulassungsantrag dieser Unternehmen in der EU zu rechnen.
Wann Studiendaten vorliegen ist noch unklar
Studien mit Kindern unter 12 Jahren gehören laut vfa sowohl für Biontech/Pfizer als auch für Moderna und AstraZeneca zu den Auflagen der EMA, die an die Bedingte Zulassungen für Erwachsene geknüpft sind. Spätester Abgabetermin der Ergebnisse sei Juli beziehungsweise Dezember 2024.
Das Paul-Ehrlich-Institut, das für die Sicherheit von Impfstoffen zuständig ist, betont: Impfstoffe werden nur für die Altersgruppen zugelassen, für die Daten zur Wirksamkeit und Sicherheit aus klinischen Prüfungen vorliegen. Die Zulassung würde dann durch eine sogenannte Änderungsanzeige zur bestehenden Zulassung auf Jüngere ausgedehnt.
Aber selbst wenn Produkte verfügbar sind, heißt das noch nicht, dass sie eingesetzt werden. Auf die Frage „Wird es eine Impfempfehlung für Kinder gegen COVID-19 geben?“, antwortete das Robert Koch-Institut Anfang Januar: „Das ist bisher noch nicht absehbar.“ (dpa/run)