DAK-Report
AMNOG-Report: Umgang mit Orphan Drugs in der Diskussion
Der neue AMNOG-Report der DAK-Gesundheit skizziert, an welchen Baustellen die Selbstverwaltung und die Ampel-Koalition bei der frühen Nutzenbewertung nachjustieren sollten.
Veröffentlicht: | aktualisiert:
Orphan Drugs treiben die Preisentwicklung von Arzneimittel voran – sie bilden das Schwerpunktthema des DAK-Reports.
© Sven Bähren / Stock.Adobe.com
Hamburg. Die frühe Nutzenbewertung neuer Arzneimittel im Rahmen des AMNOG genießt breite Anerkennung und wird ganz überwiegend als Erfolgsmodell angesehen. Im Kern hat der Gesetzgeber keine „4. Hürde“ administriert, sondern die Zahlungsbereitschaft wird zwischen Pharmahersteller und dem GKV-Spitzenverband ausgehandelt.
Doch angesichts der Dynamik des Arzneimittelmarkts ist auch die Weiterentwicklung des AMNOG ein kontinuierlicher Prozess – und stets mit vielen Kontroversen begleitet. Darauf verweist der AMNOG-Report 2022, der von der DAK-Gesundheit herausgegeben wird und der der „Ärzte Zeitung“ vorab vorgelegen hat.
Milliarden gespart
Demnach addiert sich das Einsparungsvolumen der im Nachgang zum Nutzenbewertungsverfahren verhandelten Erstattungsbeträge von 2011 bis Ende 2020 auf 13,4 Milliarden Euro. Für 2020 allein schätzt das Beratungsunternehmen IQVIA die Einsparungen durch Preisvereinbarungen für Innovationen auf 3,9 Milliarden Euro. Von den GKV-Gesamtausgaben für Arzneimittel von 43,3 Milliarden Euro (2020) entfielen 14,3 Milliarden Euro auf patentgeschützte Präparate – das Ausgabenvolumen für dieses Segment hat um 25 Prozent im Vergleich zu 2019 zugenommen.
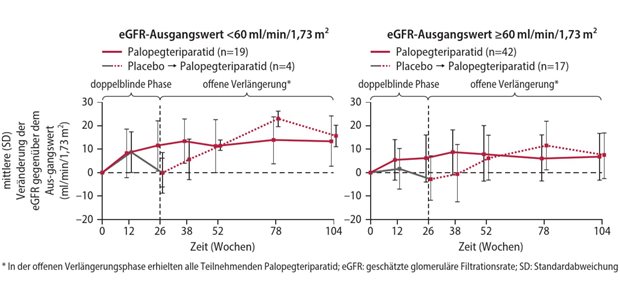
Ein „Haupttreiber“ der Entwicklung seien Orphan Drugs, heißt es – sie bilden das Schwerpunktthema des DAK-Reports. Blickt man auf die in den vergangenen zehn Jahren neu zugelassenen Orphan Drugs, so ergeben sich im Durchschnitt Jahrestherapiekosten von 126 .000 Euro. Für 2019 und 2020 verzeichnet der Bericht dagegen auf 390 .000 und 540 .000 Euro gestiegene Jahrestherapiekosten (siehe nachfolgende Grafik).„Orphan Drugs sind zu einem neuen Profitmodell für pharmazeutische Unternehmen geworden“, urteilte der Vorsitzende der Arzneimittelkommission der deutschen Ärzteschaft, Professor Wolf-Dieter Ludwig, bei der Vorstellung des Reports am Dienstag. Tatsächlich habe sich ein Teil der Arzneimittel gegen seltene Krankheiten, insbesondere in Onkologie, von einem Nischenprodukt für ganz wenige Patienten durch sukzessive Indikationsausweitung zu Blockbustern mit weltweiten Milliarden-Umsätzen entwickelt.
Zugleich ist die Zusatznutzenbilanz in diesem Segment unterdurchschnittlich: Über alle seit 2011 bewerteten Wirkstoffe hinweg sah der Gemeinsame Bundesausschuss bei 64 Prozent – zumindest in einem Teilanwendungsgebiet – einen Zusatznutzen als belegt an. Dagegen konnte bei der Erstbewertung nach Markteintritt bei zwei Drittel aller Orphan Drugs das Ausmaß des Zusatznutzens nicht quantifiziert werden. Betrachtet man nur den Zeitraum von 2016 bis 2020, so ist dieser Anteil noch weiter auf 78 Prozent gestiegen.
Option Imterimspreise?
Kassenverbände haben als Reaktion auf diese Entwicklung die Einführung sogenannter Interimspreise vorgeschlagen, die gelten sollen, solange noch kein verhandelter Erstattungsbetrag vorliegt. Allerdings seien die Kriterien, an denen sich ein Interimspreis orientieren könnte, in den derzeit diskutierten Modellen noch vage, heißt es im Report. Unklar ist auch, wie in solchen Fällen mit therapeutischen Solisten umzugehen wäre – wenn also eine Orientierung an den Kosten einer zweckmäßigen Vergleichstherapie nicht möglich ist.
Im Koalitionsvertrag der Ampel findet sich als konkretes Instrument lediglich eine Rückwirkung des Erstattungsbetrags auf den Zeitpunkt des GBA-Beschlusses – regelhaft spätestens zu Beginn des siebten Monats nach Einführung eines neuen Arzneimittels. Nach Berechnungen des Gesundheitsökonomen Professor Wolfgang Greiner, einer der Autoren des Reports, würde dieser Schritt die GKV um etwa 80 Millionen Euro pro Jahr entlasten. Bei Rückwirkung auf den Tag der Einführung wären Einsparungen von 140 Millionen Euro möglich – berechnet auf der Basis der Jahre 2016 bis 2019.
Arzneimittelpolitik
IQWiG: Nutzenfiktion für Orphans „irreführend“
Insbesondere Wirkstoff-Solisten bereiten Kassenmanagern besondere Kopfzerbrechen. Denn sie vergrößern einerseits das medikamentös behandelbare Patientenkollektiv in Indikationen, die sich ohnehin schon durch hohe Preise auszeichnen. Andererseits substituieren diese Orphan-Solisten keine bestehenden Therapien – die Ausgaben fallen also add-on an.
Nur etwa sechs Prozent aller derzeit bekannten seltenen Krankheiten seien mit Arzneitherapien zu behandeln, sagt DAK-Vorstandschef Andreas Storm, also ein Bruchteil der Orphan Diseases insgesamt. Storm hält es daher für notwendig, die Privilegien für Orphan Drugs auf tatsächliche Solisten zu beschränken, also jenen Krankheiten, für die es bislang keinerlei Behandlungsoptionen gebe.
An weiteren Herausforderungen für die AMNOG-Regulation ist kein Mangel. Beispiel Einmaltherapien: Hier kann der Hersteller bei rascher Marktdurchdringung nach Zulassung den Großteil seines erwarteten Umsatzes generieren – der Erstattungsbetrag realisiert nur noch geringe Einsparungen. Hinzu kommt: Wie können Therapiekosten einer Einmaltherapie überhaupt in Relation zu einem vergleichbaren Medikament in Dauertherapie gesetzt werden?
Kombi-Therapien: Wie regulieren?
Wieder neue regulatorische Fragen stellen sich, wenn hochpreisige Arzneimittel in Kombination angewendet werden. In der AMNOG-Logik bezieht sich der einheitliche Erstattungsbetrag auf den einzelnen Wirkstoff. Weder Hersteller und Kassen, noch das Schiedsamt dürfen bisher Erstattungsbeträge für simultane oder sequenzielle Kombinationen vereinbaren – es fehlt dafür an einem gesetzlichen Verhandlungsauftrag. Hier wäre der Gesetzgeber gefragt. Der Vorschlag eines „Kombi-Herstellerabschlags“ müsste viele Varianten abdecken: Eine Kombination mit Präparaten mehrerer Hersteller sowie den Einsatz AMNOG-bewerteter sowie noch nicht bewerteter Wirkstoffe.
Der unparteiische GBA-Vorsitzende Professor Josef Hecken macht bei Herstellern ein zu geringes oder gar nicht vorhandenes Interesse an Evidenzgewinnung nach der Zulassung aus. Das liege auch daran, dass Auflagen der EMA, die bei der Zulassung erteilt werden, bei Nichterfüllung durchweg sanktionslos blieben. Als Handlungsoptionen sieht er, die Umsatzgröße, ab der ein Orphan Drug die reguläre Nutzenbewertung durchlaufen muss, von derzeit 50 auf 25 Millionen Euro jährlich zu senken und zudem häufiger als bislang in Nutzenbewertungsentscheidungen eine anwendungsbegleitende Datenerhebung zur Evidenzgewinnung zu beschließen.
Das im DAK-Report skizzierte Panorama neuer regulatorischer Notwendigkeiten ist groß. Noch größer dürfte die Herausforderung sein, die Kernidee des AMNOG – den Ausgleich von Innovationsoffenheit und Kostendämpfung – in ein AMNOG 2.0 zu retten. (Mitarbeit: HL)