Gemeinsamer Bundesausschuss
Drei weitere Brustkrebs-Biomarker auf Kassenkosten
Der GBA hat nach dem Oncotype-DX-Test drei weitere Biomarker in den Leistungskatalog der GKV aufgenommen, die eine Entscheidung für oder gegen eine Chemotherapie bei Brustkrebs erleichtern helfen.
Veröffentlicht:
Untersuchung auf Brustkrebs. Gibt es einen positiven Befund, kann mit den Biomarkertests herausgefunden werden, wie hoch die Aktivität von verschiedenen Genen in den Krebszellen ist. (Symbolbild mit Fotomodell)
© LStockStudio / stock.adobe.com
Berlin. Gegen die Stimmen des GKV-Spitzenverbandes hat der Gemeinsame Bundesausschuss (GBA) jüngst mehrheitlich entschieden, dass die Krankenkassen künftig auch die biomarkerbasierten Testverfahren EndoPredict, MammaPrint und Prosigna bezahlen müssen. Damit stehen Ärzten nach der Zulassung von OncotypeDX im vergangenen Jahr künftig vier verschiedene Verfahren zur Verfügung.
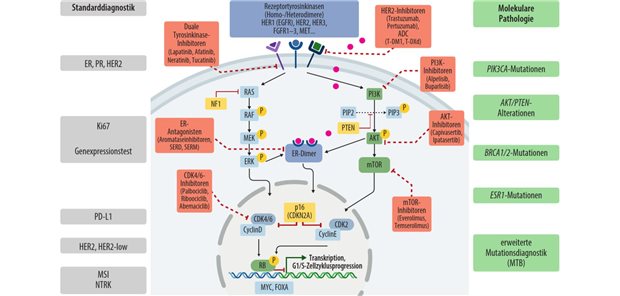
Jährlich wird bei 70 .000 Frauen in Deutschland Brustkrebs in einem frühen Stadium diagnostiziert. Bei etwa 20 .000 dieser Patientinnen reichen klinisch-pathologische Kriterien nicht aus, um eine eindeutige Therapieempfehlung für oder gegen eine adjuvante Chemotherapie zu geben. Als Folge dessen wird ein erheblicher Teil von Frauen belastend behandelt, obwohl dies nicht erforderlich ist. Mit den Tests kann untersucht werden, ob die Aktivität von verschiedenen Genen in den Krebszellen – und damit das Rezidivrisiko – niedrig oder hoch ist.
GKV stimmt gegen Aufnahme
Die Entscheidung war nicht unumstritten. Gegen eine Aufnahme in den GKV-Leistungskatalog hatte der GKV-Spitzenverband argumentiert, dass für die drei neuen Tests – anders als beim Oncotype-DX-Test – keine randomisierten klinischen Studien zum Nachweis der Zuverlässigkeit ihrer Vorhersagekraft vorgelegt worden sind. Es gebe lediglich verschiedene Studien mit unterschiedlichen Probandenkollektiven. Daher könne es sein, dass die Testergebnisse nach Wahl des Testverfahrens unterschiedlich ausfallen.
Dagegen wandten der GBA-Vorsitzende Josef Hecken und Dr. Sibylle Steiner von der KBV ein, dass die drei neuen Testverfahren Leistungsbestandteil von Selektivverträgen sind und überdies auch von Leitlinien der Fachgesellschaften empfohlen werden.
Die GBA-Entscheidung bedarf noch der Genehmigung des Bundesgesundheitsministeriums. Ferner muss der Bewertungsausschuss von KBV und GKV-Spitzenverband die Leistung in den EBM aufnehmen.
Erneut verlängert hat der GBA seinen Nutzenbewertungsbeschluss zu Palbociclib bei postmenopausalen Patientinnen in der Erstlinientherapie. Ziel der Befristung war es, im Dossier die finalen Ergebnisse der PALOMA-2-Studie zu berücksichtigen.
Verlängerung für Palbociclib
Der pharmazeutische Unternehmer habe dargelegt, dass die im Protokoll definierten Ereignisse für die finale Analyse aufgrund einer weiteren Verlangsamung der Ereignisrate vor Ende 2021/Anfang 2022 nicht erreicht werden kann. Als Folge dessen hat der GBA die Frist um eineinhalb Jahre auf den 1. Juli 2022 verlängert. (HL)