Gemeinsamer Bundesausschuss
Orphan-Entscheidungen des G-BA: Zusatznutzen bleibt unklar
Allein in diesem Monat hat der Gemeinsame Bundesausschuss Nutzenbewertungen zu vier Wirkstoffen für die Behandlung seltener Erkrankungen entschieden – in drei Fällen war der Zusatznutzen nicht quantifizierbar.
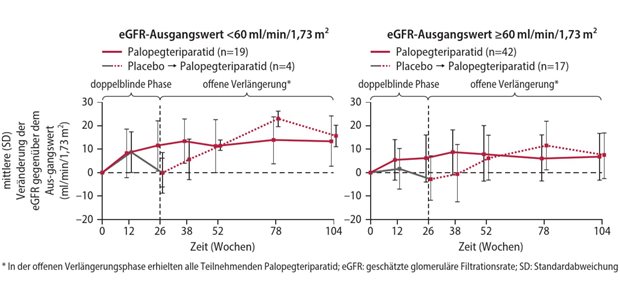
Veröffentlicht:Berlin. Einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen hat der Gemeinsame Bundesausschuss (G-BA) dem Orphan-Drug-Wirkstoff Lonapegsomatropin zur Behandlung von Kindern und Jugendlichen im Alter zwischen drei und 18 Jahren mit Wachstumsstörungen aufgrund unzureichender Sekretion des endogenen Wachstumshormons zuerkannt. In Bezug auf die Morbidität – in diesem Fall das erreichte Körperwachstum – zeige sich ein kleiner, aber statistisch signifikanter Vorteil. Inwieweit das von klinischer Relevanz sei, lasse sich derzeit nicht abschätzen, hierzu müssten noch Langzeiterfahrungen abgewartet werden.
Anderer Auffassung war dagegen die Patientenvertretung, die das jährliche Größenwachstum von 0,89 Zentimetern als durchaus relevant für die betroffenen Patienten bewertet. Sie plädierte daher für die Anerkennung eines geringen Zusatznutzens.
Teils zu dünne Studienlage
Ebenfalls einen nicht quantifizierbaren Zusatznutzen sah der Bundesausschuss für Talquetamab, das als Orphan Drug für die Behandlung Erwachsener mit rezidiviertem und refraktärem multiplen Myelom, die zumindest zuvor drei Therapien erhalten haben, zugelassen ist. Die Vorbehandlungen müssen mit einem immunmodulatorischen Wirkstoff, einem Proteasom-Inhibitor und einen Anti-CD38-Antikörper erfolgt sein. Trotzdem muss eine Krankheitsprogression vorgelegen haben. Der pharmazeutische Unternehmer hatte zum Nutzennachweis eine einarmige Studie vorgelegt, die keinen Vergleich ermöglichte,so dass sich der G-BA keine Meinung über das Ausmaß des zusätzlichen Nutzens bilden konnte.
Auch für die Indikationserweiterung des Orphan Drugs Sirolimus zur Behandlung von mit tuberöser Sklerose assoziiertem fazialen Angiofibroms bei Erwachsenen, Kindern und Jugendlichen ab sechs Jahren erkannte der Bundesausschuss einen Anhaltspunkt auf nicht quantifizierbaren Zusatznutzen. Die Größenordnung des Behandlungseffekts sei aufgrund der Studienlage nicht abschätzbar.
Keinen Zusatznutzen sah der Bundesausschuss für Pegunigalsidase alfa als langfristige Enzymersatztherapie bei Erwachsenen mit Morbus Fabry im Vergleich zu Agalsidase. Aufgrund der vom Hersteller vorgelegten RCT-Daten konnten keine statistisch signifikanten Unterschiede bei der Morbidität – Schmerz und Gesundheitszustand – festgestellt werden; zur Lebensqualität waren keine Daten verfügbar. Die Jahrestherapierkosten des ehemaligen Orphan Drugs (bis 2017) liegen nach Angaben des G-BA bei 359.000 Euro, die der zweckmäßigen Vergleichstherapie mit 245.000 bis 350.000 Euro allerdings auch in einer ähnlichen Größenordnung. (HL)