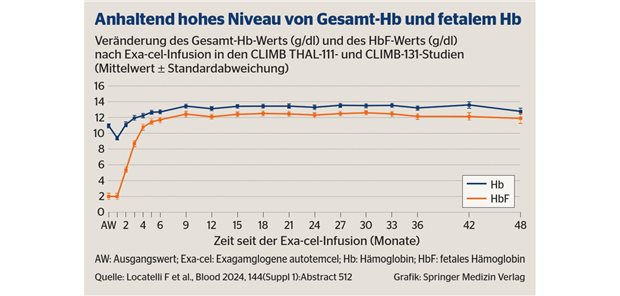
Phase-III-Studie
Prostatakrebs-Medikament: Bayer beantragt EU-Zulassung für weitere Indikation
Der Pharmakonzern Bayer hat für sein Medikament Nubeqa® gegen Prostatakrebs die EU-Zulassung in einer weiteren Indikation beantragt. Der Umsatz des Medikaments war 2023 stark gewachsen und dürfte 2024 die Milliardenmarke knacken.
Veröffentlicht:Berlin. Der Pharma- und Agrarchemiekonzern Bayer hat für sein Medikament Nubeqa® gegen Prostatakrebs die EU-Zulassung in einer weiteren Indikation beantragt. Das teilte das Unternehmen am Montag mit.
Der Schritt basiert auf den Daten im Sommer vorgelegten Daten der Phase-III-Studie Aranote zu Patienten mit metastasiertem hormonsensitivem Prostatakrebs und war angekündigt worden. Nubeqa® (Wirkstoff Darolutamid) in Kombination mit einer Hormontherapie hatte das radiologische progressionsfreie Überleben (rPFS) im Vergleich zu Placebo deutlich verlängert.
Nubeqa® ist bereits in vielen Ländern in Kombination mit einer Hormon- und einer Chemotherapie zur Behandlung von Patienten mit metastasierendem hormonsensitivem Prostatakrebs (mHSPC) zugelassen.
Außerdem wird das Medikament zur Behandlung von Patienten mit nicht-metastasiertem kastrationsresistentem Prostatakarzinom mit einem hohen Risiko für die Entstehung von Metastasen (Hochrisiko-nmCRPC) eingesetzt. Der Umsatz des noch jungen Medikaments war 2023 stark gewachsen und dürfte 2024 die Milliardenmarke knacken. (dpa)