Bundesrat
GVWG sorgt für Verschnaufpause bei Wundversorgern
Hersteller bestimmter innovativer Wundversorgungslösungen haben nun definitiv bis zum 1. Dezember 2023 Zeit, dem GBA einen Nutzennachweis für ihre Produkte zu erbringen, um sie erstattungsfähig zu halten.
Veröffentlicht: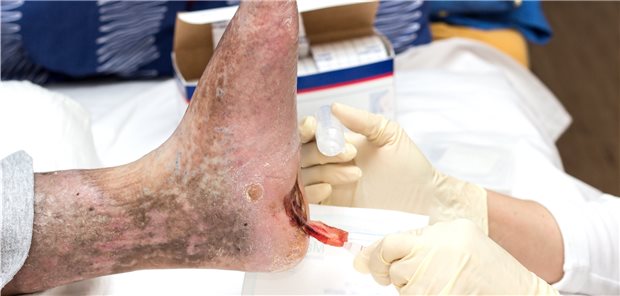
Moderne Wundversorgung kann beim diabetischen Fuß in Frage kommen. Anbieter „sonstiger Produkte zur Wundbehandlung“ haben nun bis 1. Dezember 2023 Zeit, dem GBA den Nutzen ihrer Produkte nachzuweisen, um sie erstattungsfähig zu halten.
© Heike Brauer / Shotshop / picture alliance
Berlin. Der Bundesrat hat ein Herz für die moderne Wundversorgung. Nachdem zum 2. Dezember 2020 ein in der Branche heftig umstrittener Beschluss des Gemeinsamen Bundesausschusses (GBA) zu Verbandmitteln und sonstigen Produkten zur Wundbehandlung in Kraft getreten ist, der die Branche mit einer verengten Verbandmitteldefinition ins Mark zu treffen droht, sollten Anbieter „sonstiger Produkte zur Wundbehandlung“, wozu unter anderem eine Vielzahl an silberhaltigen Wundauflagen zählt, künftig ihren Nutzen gesondert nachweisen und ein Bewertungsverfahren durchlaufen. Erst danach werden sie durch die Gesetzliche Krankenversicherung (GKV) weiterhin verordnungsfähig sein.
Die Übergangsfrist für die betroffenen Produkte sollte ursprünglich nur ein Jahr dauern, dann hat der Bundestag mit der Verabschiedung des Gesundheitsversorgungs-Weiterentwicklungsgesetzes (GVWG) den Zeitraum auf 36 Monate verlängert. Der Bundesverband Medizintechnologie (BVMed) begrüßte am Freitag die Zustimmung des Bundesrates.
Kommentar zu Wundprodukten
GBA auf Anarchie-Kurs?
„Es ist sehr erfreulich, dass der Gesetzgeber zu dieser späten Einsicht gelangt ist. Die jetzt auf drei Jahre verlängerte Übergangsfrist verschafft den betroffenen Unternehmen die unbedingt notwendige Zeit, um die neu geforderten Nachweise zu erbringen. Gleichzeitig sorgt das bei den Anwendenden und nicht zuletzt den Patient:innen für die erforderliche Sicherheit bei der Verordnung ihrer benötigten und seit Langem bewährten Produkte“, kommentiert Juliane Pohl, Leiterin Ambulante Versorgung beim BVMed.
Der GBA sei seiner Bringschuld allerdings noch immer nicht nachgekommen, moniert der BVMed. „Die Unternehmen warten noch immer auf die Evidenzkriterien für die Nutzennachweise. Der GBA muss hier dringend und schnell die nötige Klarheit schaffen, damit die Unternehmen sich auf das Verfahren einstellen und die geforderten Nachweise überhaupt erbringen können“, so Pohl.
Neue Regelung trifft rund 400 Produkte
Von der neuen Regelung betroffen sind viele bisher als Verbandmittel in der GKV erstattungsfähige Produkte, wie etwa silber- oder PHMB-haltige Wundauflagen. Sie gelten nach dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) aus dem August 2019 als „sonstige Produkte zur Wundbehandlung“. Um in die Arzneimittel-Richtlinie des GBA aufgenommen und damit erstattungsfähig zu werden, ist künftig ein Bewertungsverfahren erforderlich.
„Leider liegen die Anforderungen für dieses Verfahren noch nicht vor. Damit haben die Unternehmen weiter keine Planungssicherheit für aufwändige und ressourcenintensive Studien“, resümiert Pohl. Und ergänzt: „Aus Sicht des BVMed ist auch ein verbindlicher Beratungsanspruch der Hersteller zu den Kriterien beim G-BA zwingend nötig, damit nicht Studien geplant und durchgeführt werden, die der G-BA dann am Ende nicht anerkennt.“