Votum des CHMP
EMA empfiehlt Zulassung von COVID-Vakzine Comirnaty® ab 12 Jahren
Die deutsche Politik war schneller: Sie hat Donnerstag schon die Impfung für Kinder und Jugendliche ab 12 Jahren in Aussicht gestellt. Jetzt hat auch die EMA die entscheidende Grundlage dafür geliefert – und für die Zulassung votiert.
Veröffentlicht: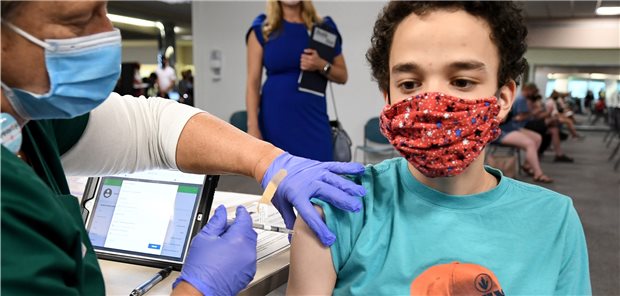
In den USA schon möglich und jetzt auch in der EU: Corona-Impfung für Kinder und Jugendliche ab zwölf Jahren mit Comirnaty®, wie hier in Florida.
© Paul Hennessy / SOPA / ZUMA Wire / picture alliance
Amsterdam. Ärzte dürfen künftig die mRNA-Vakzine Comirnaty® von BioNTech/Pfizer gegen SARS-CoV-2 auch bei Kindern und Jugendlichen ab 12 Jahren einsetzen. Das hat der Humanarzneiausschuss CHMP der Europäischen Arzneimittelagentur EMA am Freitag in Amsterdam entschieden. Formal muss die Erweiterung der bedingten Zulassung die EU-Kommission beschließen. Dies könnte noch in den kommenden Tagen geschehen.
Der Impfstoff soll wie bei Erwachsenen in zwei Dosen zu je 0,3 ml im Abstand von mindestens 21 Tagen verabreicht werden. „Die Vakzine ist sicher bei den Kindern“, sagte Dr. Marco Cavaleri, Head of Biological Health Threats and Vaccines Strategy. „Es bleibt bei jedem EU-Mitgliedsstaat, ob und wann die Vakzine dort eingesetzt werden soll.“
Die Vakzine (BNT162b2) ist bislang für Menschen ab 16 Jahren zugelassen. Auch für den mRNA-Impfstoff von Moderna, der derzeit ab 18 Jahren in der EU zugelassen ist, liegt ein ähnlich lautender Antrag auf Zulassungsweiterung vor.
In Deutschland hatten sich die Länderchefs und Bundeskanzlerin Merkel am Donnerstagabend darauf verständigt, dass alle Bürger ab 12 Jahren ab dem 7. Juli ohne Priorisierung die Impfung erhalten dürfen.
Keine Sorge vor der Haftung
Eine Impfempfehlung der Ständigen Impfkommission (STIKO) liegt noch nicht vor, wird aber für die kommenden Tage erwartet. Der Vorsitzende Professor Thomas Mertens hatte sich zuletzt kritisch gegenüber einer generellen Empfehlung für Kinder geäußert.
Allerdings ist für Ärzte die STIKO-Empfehlung bei den COVID-19-Schutzimpfungen keine zwingende Voraussetzung für die Impfung. Eine Impfung darf bekanntlich schon dann appliziert werden, sofern sie sich innerhalb der Zulassungsvorgaben bewegen. Dazumal die Finanzierung sämtlicher COVID-Impfungen ohnehin bislang der Steuerzahler übernimmt.
Speziell bei SARS-CoV-2-Impfungen müssen Ärzte jetzt auch keine Haftungsprobleme befürchten. Denn diesen Freitag hat der Bundesrat das „Zweite Gesetz zur Änderung des Infektionsschutzgesetzes und weiterer Gesetze“ beschlossen. Das sieht in Paragraf 60 des Infektionsschutzgesetzes (IfSG) die Ergänzung vor, dass die Versorgungsämter für Impfschäden nach einer Corona-Impfung unabhängig von einer dezidierten Impfempfehlung aufkommen müssen.
Phase-III-Studienergebnisse veröffentlicht
Die EMA verweist in ihrer Zulassungsempfehlung auf erste Phase-III-Studienergebnisse, die Anfang dieses Jahres erhoben wurden und just in der Nacht zum Freitag publiziert wurden. Danach traten unter Verum mit 1131 Probanden im Alter von 12 bis 15 Jahren keine Infektionen auf, bei den 1129 Kindern, die Placebo erhielten, waren es 16 Fälle.
Dadurch ergibt sich eine relative Risikoreduktion (RRR) für eine Corona-Infektion von 100 Prozent. Gemessen am zweimonatigen Follow-up in der Studie würde sich das absolute Risiko um 8,5 Prozentpunkte reduzieren. Das wäre eine Number-Needed-to-Vaccinate (NNV) von 12 Impflingen, um eine Infektion in dieser Kohorte zu verhindern. Allerdings wurden nur 58 Prozent der Probanden für mindestens zwei Monate nachverfolgt. Die Studie wurde ausschließlich an Zentren in den USA durchgeführt.
An Nebenwirkungen ermittelten die Autoren nach der ersten Dosis in 86 Prozent der mit Comirnaty® geimpften 12- bis 15-Jährigen Schmerzen an der Einstichstelle und bei 60 Prozent Fieber. 55 Prozent hatten Kopfschmerzen, 28 Prozent Schüttelfrost, bei 24 Prozent traten Myalgien auf. Nach der zweiten Impfdosis waren die Nebenwirkungsraten etwas höher. (nös)