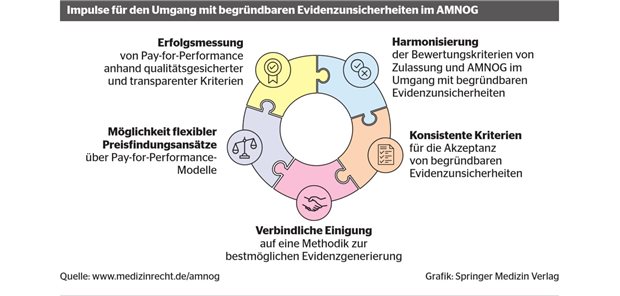
Nutzenbewertung
Bundesgesundheitsministerium hilft GBA auf die Sprünge
Das Bundesgesundheitsministerium gibt dem GBA wertvolle Tipps, worauf bei der anwendungsbegleitenden Datenerhebung zu achten ist.
Veröffentlicht:
Zusatznutzen? Um Evidenzlücken bei Orphan Drugs oder bedingt zugelassenen Produkten zu schließen, kann der GBA Daten aus der Praxis anfordern.
© Mark Poprocki / stock.adobe.com
Berlin. Das Bundesgesundheitsministerium (BMG) hat den Juli-Beschluss des GBA zur Änderung seiner Geschäftsordnung gebilligt, mit dem das Selbstverwaltungsgremium das „Verfahren zur Forderung einer anwendungsbegleitenden Datenerhebung“ regelt.
Gleichzeitig gibt das BMG in seinem Genehmigungsschreiben, das der Redaktion vorliegt, ergänzende Verfahrenshinweise. Offenbar ist man im BMG der Ansicht, der GBA könnte den Willen des Gesetzgebers in Sachen Evidenz-Ermittlung anhand sogenannter Real-World-Daten noch nicht zur Gänze erfasst haben.
Das betrifft etwa die Möglichkeit, Hersteller-Dossiers einer begleitenden Erhebung wegen methodischer Mängel zurückzuweisen: Diese Möglichkeit habe der GBA nämlich dann nicht, betont das Ministerium, wenn sich ein Unternehmen an dessen Vorgaben gehalten hat. Paragraf 7 Absatz 2a der Arzneimittel-Nutzenbewertungsverordnung sehe ausdrücklich vor, dass Daten aus einer anwendungsbegleitenden Erhebung „zur Nutzenbewertung heranzuziehen (sind)“.
Der GBA müsse daher bereits bei der Anlage einer solchen Datenerhebung „berücksichtigen, auf welche Art und Weise die Ergebnisse zur Quantifizierung eines Zusatznutzens im Rahmen der Nutzenbewertung herangezogen werden können“.
Ethikkommission hat bei klinischem Test mitzureden
In einem zweiten Passus erläutert das BMG, welche Studien-Settings zulässig sind. Auf jeden Fall keine Randomisierung, da in diesem Kontext Ärzten „keine Vorgaben zur Arzneimittelanwendung“ gemacht werden dürften. „Bei einer anwendungsbegleitenden Datenerhebung kann es sich etwa um Anwendungsbeobachtungen, Fall-Kontroll-Studien oder Registerstudien handeln.“
Welches Setting der GBA wählt, habe er „im konkreten Fall nach den Grundsätzen der Zweckmäßigkeit und Verhältnismäßigkeit zu entscheiden“. Fordert er eine nicht randomisierte klinische Prüfung – unter Evidenz-Gesichtspunkten vermutlich die schärfste Form einer anwendungsbegleitenden Datenerhebung –, sei einzukalkulieren, dass dieser Studien-Typus der Zustimmung einer Ethikkommission sowie der zuständigen Bundesoberbehörde bedarf, bei Arzneimittel ist das das BfArM.
Das Instrument der anwendungsbegleitenden Datenerhebung wurde mit dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV) eingeführt (§ 35a Abs. 3b SGB V). Für Orphan Drugs und Präparate, die unter Auflagen von der EU-Kommission zugelassen wurden, kann der GBA vom Hersteller Daten aus der therapeutischen Praxis anfordern, um eventuell Evidenzlücken, die bei der Zulassung noch bestanden, schließen und das Ausmaß des Zusatznutzens besser beurteilen zu können. Das erste Produkt, für das ein solches Verfahren gestartet wurde, ist die Gentherapie Zolgensma®. (cw)