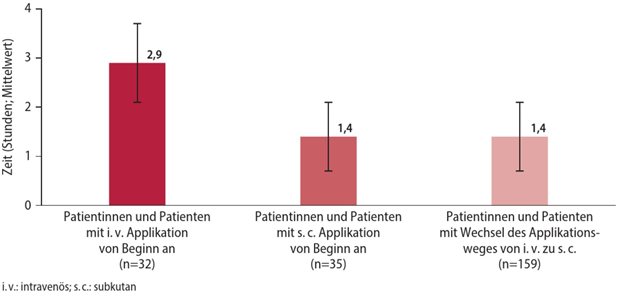
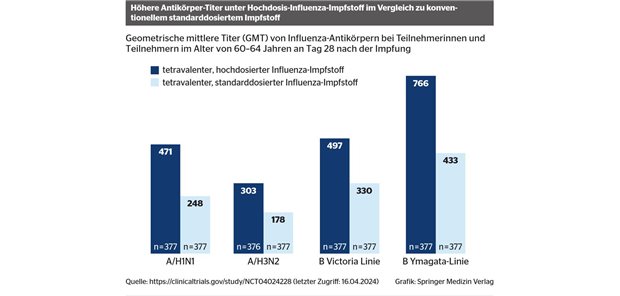
Reinhardt zu Zulassung
Corona-Impfstoff: BÄK-Präsident fordert mehr Tempo von der EMA
Großbritannien ist bei der Impfstoffzulassung vorgeprescht. Jetzt macht der -Präsident der Bundesärztekammer, Dr. Klaus Reinhardt, Druck: Die Europäische Arzneimittel-Agentur solle sich bei der Prüfung sputen.
Veröffentlicht:
BÄK-Präsident Reinhardt wünscht sich eine zügigere Bearbeitung des Zulassungsantrags für den Corona-Impfstoff.
© Wolfgang Kumm/dpa
Berlin. Bundesärztekammerpräsident Dr. Klaus Reinhardt hat eine schnellere Zulassung des Impfstoffs der Unternehmen BioNTech und Pfizer gefordert. „Ich glaube, dass man das schneller schaffen kann“, sagte Reinhardt am Freitagmorgen im Deutschlandfunk. Sein Eindruck sei, dass Zeit verschwendet werde, sagte der Allgemeinmediziner. Bislang steht im Raum, dass erste Impfungen voraussichtlich im Januar starten können.
Gesundheitsminister Jens Spahn hatte in dieser Woche beim virtuellen Treffen der EU-Gesundheitsminister vollen Einsatz von der Europäischen Arzneimittelagentur (EMA) gefordert. Er erwarte, dass „Tag und Nacht und an Wochenenden“ an der Zulassung gearbeitet werde.
„Ich glaube, dass die europäische Behörde sich vielleicht mit noch mehr Druck und Engagement daran machen könnte, das zu prüfen“, sagte Reinhardt jetzt. Es finde ja keine weitere Prüfung des Impfstoffes an sich statt. Vielmehr stehe „ja nur eine Prüfung von in den letzten Monaten stattgefundenen Studien“ an. Es gehe darum nachzuvollziehen, ob die bisherigen Arbeiten am Impfstoff valide seien. Reinhardt forderte die Europäische Union auf, auf die Zulassungsbehörden einzuwirken, um die Verfahren zu beschleunigen.
Mehrere Zulassungsschritte
In einem ersten Schritt muss nun die EMA eine Empfehlung für die Zulassung aussprechen, die dann durch die Europäische Kommission erfolgt. Danach muss noch das Paul-Ehrlich-Institut als zuständige Oberbehörde den Impfstoff freigeben.
Die Impfstoffentwicklung aus Mainz wird von der EMA bereits seit einiger Zeit im so genannten Rolling-View-Verfahren begleitet. Das heißt, dass Daten aus den klinischen Studien bereits im Verfahren an die EMA zur Prüfung weitergeleitet wurden. Der Prüfprozess ist also bereits im Gange.
Großbritannien hat in dieser Woche bereits eine Zulassung für den neuen Impfstoff ausgesprochen. Seit Anfang des Jahres ist das vor dem Austritt aus der EU stehende Land in Arzneimittelfragen nicht mehr an die Einhaltung europäischer Verfahren gebunden. (af)