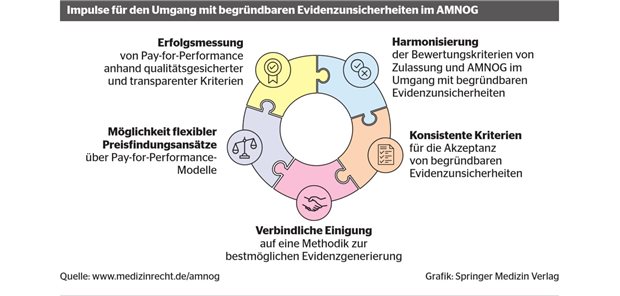
Entwicklung
Das AMNOG hat gelernt
Das am 1. Januar 2011 in Kraft getretene AMNOG hat die letzte Lücke der Preisregulierung auf dem deutschen Arzneimittelmarkt geschlossen. Der AMNOG-Prozess wurde seither siebenmal novelliert.
Veröffentlicht:Berlin. Das am 1. Januar 2011 in Kraft getretene AMNOG hat die letzte Lücke der Preisregulierung auf dem deutschen Arzneimittelmarkt geschlossen. Seitdem mussten alle Arzneimittel mit neuen Wirkstoffen sowie mit noch patentgeschützten Wirkstoffen eine frühe Nutzenbewertung durchlaufen.
Basierend auf dem vom Gemeinsamen Bundesausschuss festgestellten Zusatznutzen – die Kategorien sind erheblich, beträchtlich, gering, nicht quantifizierbar, kein Zusatznutzen – verhandeln Hersteller und GKV-Spitzenverband den Erstattungsbetrag, bei Nichteinigung entscheidet eine Schiedsstelle. Neben den intrinsischen Lernprozessen der Beteiligten hat der Gesetzgeber den AMNOG-Prozess insgesamt siebenmal novelliert:
- 2012: 2. AMGÄndG: Neueinreichung von Dossiers möglich, wenn das erste unvollständig war; Beteiligung der Zulassungsbehörden bei Beratungen des GBA zur Planung klinischer Studien; Berücksichtigung europäischer Preise bei Erstattungsbeträgen.
- 2013: 3. AMGÄndG: Streichung des Wirtschaftlichkeitskriteriums bei der zweckmäßigen Vergleichstherapie.
- 2014: 14. SGB V ÄndG: Bestandsmarktaufruf aufgehoben; seit dem werden nur noch Arzneimittel mit neu zugelassenen Wirkstoffen bewertet.
- 2017: Arzneimittelversorgungsstärkungsgesetz: Evidenztransfer bei Kinder-Arzneimitteln möglich; Berücksichtigung der Resistenzsituation bei Antibiotika; zwingende Aufnahme von Companion Diagnostics in den EBM; Erstattungsbetrag gilt auch für Krankenhäuser.
- 2019: TSVG: Nutzenbewertung auch in Englisch.
- 2019: Gesetz für mehr Sicherheit in der Arzneimittelversorgung (GSAV): Anwendungsbegleitende Datenerhebung, Qualitätssicherungsrichtlinie für Advanced Therapy Medicinal Products (ATMP); Beteiligung von Fachgesellschaften und Arzneimittelkommission der deutschen Ärzteschaft.
- 2020: Faire-Kassenwahl-Gesetz: Erlass anwendungsbegleitender Datenerhebung frühestens zum erstmaligen Inverkehrbringen; ATMP werden in die frühe Nutzenbewertung einbezogen; Freistellung von Reserveantibiotika von der frühen Nutzenbewertung. (HL)