„Implant Files“ über fehlerhafte Medizinprodukte
MedTech und Kliniken gehen in die Offensive
Viele Medizinprodukte seien fehlerhaft und gefährden Patienten, berichten investigative Journalisten. Diese Vorwürfe rufen die Branche, den Gesundheitsminister und die Krankenhausgesellschaft auf den Plan.
Veröffentlicht: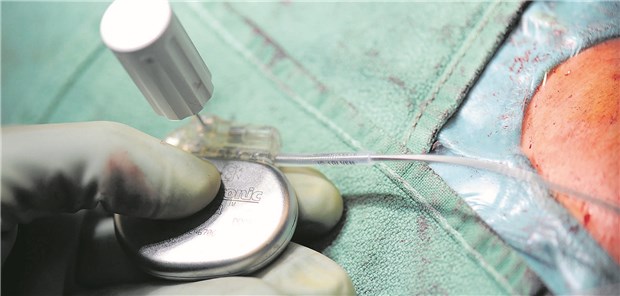
Aktive Implantate stellen hohe Anforderungen an Hersteller wie auch Operateure.
© Mathias Ernert, Deutsches Herzze
MÜNCHEN/BERLIN/BRÜSSEL. Bundesgesundheitsminister Jens Spahn (CDU) will angesichts von Problemen mit Implantaten für mehr Transparenz bei Medizinprodukten sorgen.
„Wir bauen eine industrieunabhängige Stelle auf, bei der alle verbauten Implantate gemeldet werden müssen“, sagte Spahn der „Rheinischen Post“ (Dienstagsausgabe). Zugleich räumte er Defizite ein.
Gebe es heute Probleme mit einem Medizinprodukt, habe das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) „keinen Gesamtüberblick über alle vergleichbaren Fälle“.
Keine Chancen, Patienten vor Fehlern zu warnen
Das Institut habe in der Folge auch keine Chance, Patienten gezielt vor Fehlern zu warnen. Mit dem Register soll außerdem nachgeprüft werden können, wie lange Implantate halten.
Spahn reagiert damit auf „Implant Files: Das gefährliche Geschäft mit der Gesundheit“ – ein Dossier, mit dem die „Süddeutsche Zeitung“ (SZ) in ihrer Montagsausgabe eine Debatte um die Implantatversorgung in Deutschland gestartet hat.
Der Tenor der Recherche von SZ, NDR und WDR in Zusammenarbeit mit dem internationalen Konsortium für Investigative Journalisten (ICIJ) sowie etwa 60 Medienpartnern: Fehlerhafte Medizinprodukte wie Implantate verursachen immer häufiger Verletzungen und auch Todesfälle.
So seien in Deutschland im vergangenen Jahr 14.034 Fälle gemeldet worden, bei denen es zu Verletzungen, Todesfällen oder anderen Problemen gekommen sei, die im Zusammenhang mit Medizinprodukten stehen könnten – Tendenz steigend, denn die Verdachtsfälle nähmen stark zu.
Schrittmachertechnologien retten Leben
Bereits am Sonntagabend, als erste Online-Meldungen zu dem Dossier lanciert worden waren, meldete sich der Bundesverband Medizintechnologie (BVMed), verbändepolitischer Heimathafen der insinuierten Implantateanbieter, umgehend zur „#ImplantFiles-Kampagne“ zu Wort.
Zunächst schickte BVMed-Geschäftsführer und Vorstandsmitglied Joachim M. Schmitt im ersten Schritt voraus, dass jeden Tag Millionen Menschen von innovativer Medizintechnik in Deutschland und der EU profitierten. Medizinprodukte wie Katheterverfahren oder Schrittmachertechnologien retteten Leben.
Dann ordnete er die spezielle Risikosituation bei bestimmten Eingriffen ein: „Bei Implantaten, die am zentralen Herzkreislaufsystem oder am zentralen Nervensystem eingesetzt werden, ist das Anwenderrisiko am höchsten. Solche Medizinprodukte müssen auf ihre Sicherheit und Leistungsfähigkeit besonders geprüft sein und dürfen nur von erfahrenen Operateuren angewendet werden“, so Schmitt.
Er spielt den Ball somit auch ins Feld der implantierenden Ärzte und deren Expertise respektive Qualifikation für entsprechende Eingriffe.
Ärzte und Kliniken müssen sich darauf verlassen können
Das lässt Dr. Gerald Gaß, Präsident der Deutschen Krankenhausgesellschaft, nicht auf den Medizinern sitzen. „Für den behandelnden Arzt und natürlich auch das Krankenhaus ist es zwingend, sich darauf verlassen zu können, dass die eingesetzten Medizinprodukte sicher sind. Und dazu müssen wir uns auch auf das Zulassungsverfahren verlassen können“, so seine Replik im Gespräch mit der „Ärzte Zeitung“.
Ergänzend geht er auf die im Mai 2017 – nicht zuletzt wegen des PIP-Brustimplantate-Skandals – novellierte EU-Medizinprodukteverordnung (MDR) ein: „Wir haben auch im Rahmen der Diskussion um die Änderung der MDR eine Übertragung dieser Aufgaben auf eine staatliche Zulassungsbehörde befürwortet, wenn die bisherige Struktur nicht ausreichend ist, um die notwendige Sicherheit der Medizinprodukte zu gewährleisten.“
Der Orthopäde und Schatzmeister des Berufsverbandes für Orthopädie und Unfallchirurgie (BVOU), Dr. Helmut Weinhart, führt die herausfordernde Versorgungssituation bei Implantaten auch auf das DRG-System zurück, das das Verwenden hochwertiger Produkte oft erschwere.
„Die Implantate müssten aus den DRG herausgenommen werden, das wäre ein erster Schritt, um marktgerechte Preise für die Implantate durchsetzen zu können.“.
Im Übrigen erhoffe sich der BVOU von den strengeren MDR-Regularien Waffengleichheit auf Anbieterseite, da künftig jedes Medizinprodukt höherer Risikoklassen – und damit auch chinesische Billiglösungen – dem strengeren Zulassungsprozess unterworfen werden.
Prüf- und Zertifizierungsstellen staatlich benannt und überwacht
Nicht gerade glücklich mit der medialen Schelte ist auch der Technologie-Verband Spectaris, dessen Mitglieder nicht direkt von den Anschuldigungen betroffen sind.
Mit Bedauern nimmt Spectaris-Geschäftsführer Jörg Mayer auf Nachfrage der „Ärzte Zeitung“ die Stoßrichtung der Medienbeiträge zur Kenntnis.
„Leider wird in der bisherigen Berichterstattung der Eindruck vermittelt, private Unternehmen würden eigenständig über den Marktzugang von Medizinprodukten bestimmen. Dabei wird unterschlagen, dass die Prüf- und Zertifizierungsstellen staatlich benannt und überwacht werden, daher heißen sie ja Benannte Stellen.“
Von der Nachrichtenagentur dpa hieß es, der oben genannte Rechercheverbund sehe es als Problem an, dass bestimmte „Medizinprodukte in Europa nicht von staatlichen Stellen kontrolliert und zertifiziert werden müssten. Vielmehr erfolge dies durch private Institute, die im Auftrag der Hersteller tätig seien“.
Klinische Prüfungen von Medizinprodukten
Mayer weist zur Klarstellung darauf hin, dass die Durchführung klinischer Prüfungen von Medizinprodukten an den gleichen Anforderungen wie für den Arzneimittelbereich orientieren.
„Man sollte darüber hinaus genau hinschauen, welche die jeweilige Fehlerursache von Medizinprodukten ist. Laut Statistik des BfArm sind die Fehlerursachen oftmals nicht im Medizinprodukt zu suchen, sondern unter anderem auch in der Anwendung begründet“, so Mayer.
Am Montag schaltete sich nun auch die EU-Kommission in die Debatte um Patientensicherheit und die ab 2020 greifende MDR ein. „Wie immer ist natürlich die Umsetzung der entscheidende Punkt“, so eine Sprecherin.
Die EU-Staaten, Hersteller und Ärzte seien aufgefordert, die strengeren Qualitäts- und Sicherheitsstandards anzuwenden und ihre Arbeit transparenter zu machen. (mit dpa-Material)
Lesen Sie dazu auch: „Implant Files“: Immer mehr Verletzte und Tote durch Medizinprodukte?