Implantate
Zertifizierung bedeutet bislang nicht Überwachung
Der Europäische Gerichtshof hat sein Urteil zur Haftung bei minderwertigen Brustimplantaten gefällt. Für betroffene Trägerinnen bedeutet die Entscheidung, dass ein Schadenersatz in immer weitere Ferne rückt.
Veröffentlicht: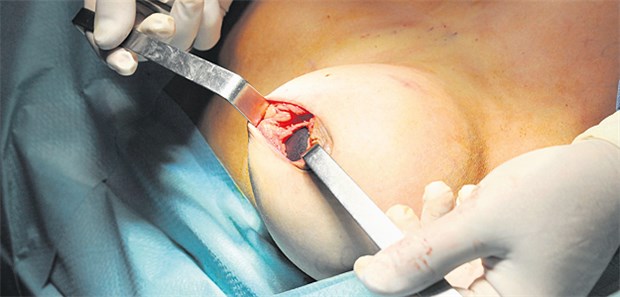
Einer Patientin wird ein minderwertiges Silikonkissen des insolventen Anbieters PIP explantiert.
© Bruno Bebert / dpa
LUXEMBURG. Im Streit um die Haftung des TÜV Rheinland für die mangelhaften Brustimplantate des französischen Herstellers Poly Implant Prothèse (PIP) hat der TÜV einen Zwischenerfolg erzielt. Wie der Europäische Gerichtshof (EuGH) am Donnerstag in Luxemburg entschied, musste der TÜV bei dem Hersteller keine unangemeldeten Inspektionen durchführen, keine Geschäftsunterlagen sichten und auch das Endprodukt nicht prüfen. Die Aussicht betroffener Frauen auf Schadenersatz ist damit gering. Inzwischen wurden in Deutschland die Zertifizierungsvorgaben für Medizinprodukte verschärft.
Verfahren zertifiziert, nicht Implantate
Das Luxemburger Urteil ist eine wichtige Klarstellung für die Medizinproduktebranche insgesamt. Denn nur dort ist das europäische CE-Siegel mit einer Zertifizierung durch ein außenstehendes Unternehmen verbunden. Die Zertifizierung betrifft bislang allerdings nur das Herstellungsverfahren und nicht das Produkt selbst.
PIP hatte hierfür den TÜV Rheinland beauftragt, der das Siegel erteilte. Die Implantate wurden zehntausendfach weltweit verkauft. Sie enthielten allerdings nicht immer das übliche Spezial-, sondern teils billigeres Industriesilikon. Die Unternehmensführung wurde deswegen im vergangenen Jahr in Frankreich bereits wegen Verbrauchertäuschung und Betruges verurteilt. Firmengründer Jean-Claude Mas bekam von dem Berufungsgericht in Aix-en-Provence eine vierjährige Haftstrafe aufgebrummt.
Nach Schätzung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) haben sich in Deutschland rund 6000 Frauen PIP-Implantate einsetzen lassen, in Frankreich sind es nach Behördenschätzung 30.000.
Nachdem sich Berichte über geplatzte und undichte Silikonkissen häuften, stoppten die französischen Behörden im April 2010 den Vertrieb. Auch in Deutschland erwies sich laut BfArM fast die Hälfte der überprüften PIP-Implantate als mangelhaft. 2012 empfahl die Behörde, die Implantate herauszunehmen.
Dem war auch die Klägerin gefolgt. Weil PIP selbst insolvent ist, verlangte sie vom TÜV Rheinland Schadenersatz und Schmerzensgeld in Höhe von 40.000 Euro. Der Bundesgerichtshof legte den Streit dem Europäischen Gerichthof (EuGH) vor.
Unangemeldete Audits keine Pflicht
Der betonte nun, dass in erster Linie der Hersteller für die Sicherheit seiner Produkte verantwortlich sei. Die Zertifizierung betreffe lediglich das Herstellungsverfahren und das Qualitätsmanagement. Das zertifizierende Unternehmen, hier der TÜV, habe daher "keine generelle Pflicht (…) zur Durchführung von unangemeldeten Inspektionen, zu Produktprüfungen und/oder zur Sichtung von Geschäftsunterlagen des Herstellers".
Allerdings habe das im EU-Recht als "Benannte Stelle" bezeichnete zertifizierende Unternehmen auch eine Sorgfaltspflicht. Es müsse daher einschreiten, wenn mögliche Mängel bekannt werden. Nach Angaben des TÜV Rheinland hatte PIP bei insgesamt acht angekündigten Kontrollen stets das eigentlich für Brustimplantate zu verwendende Spezialsilikon vorrätig. Nachdem die Behörden in Frankreich über Sicherheitsmängel berichtet hatten, habe der TÜV das CE-Zertifikat widerrufen.
Opfer in der Nachweispflicht
Nur wenn betroffene Frauen dem TÜV dennoch Verstöße nachweisen können, können sie nach dem Luxemburger Urteil Schadenersatz verlangen. Wie der EuGH weiter entschied, richtet es sich nach dem nationalen Recht, ob eine entsprechende Anspruchsgrundlage besteht. Nach deutschem Recht kann haften, wer gegen einen "Vertrag mit Schutzwirkung zugunsten Dritter" verstößt.
Hierzu stellte der EuGH klar, dass die Zertifizierung von Medizinprodukten dem Schutz der Empfänger dient und "eine schuldhafte Pflichtverletzung der Benannten Stelle folglich deren Haftung gegenüber diesen Empfängern begründet". In Deutschland nimmt die Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG) die Benennung der Zertifizierer vor.
Die EU-Kommission hatte bereits 2013 auf den PIP-Skandal reagiert und im Zuge des von dem damaligen Gesundheitskommissaren John Dalli erarbeiteten "Joint Plan for Immediate Actions" ergänzende "Empfehlungen" für implantierbare Medizinprodukte herausgegeben. Die zuständigen Behörden von Bund und Ländern haben diese im Juni 2016 für Deutschland umgesetzt. Danach soll die "Benannte Stelle" auch unangemeldete Besuche durchführen und die Produkte stichprobenartig prüfen.
Der PIP-Skandal hatte auch die Novellierung der EU-Medizinprodukterichtlinie ausgelöst, die wahrscheinlich Mitte dieses Jahres in Kraft treten wird. Diese hat nach Auskunft des Bundesverbandes Medizintechnologie zur Folge, dass alle Benannten Stellen ihre Benennung verlieren und dann bei der ZLG ein erneutes, strenger es Bennungsverfahren durchlaufen müssen. (Mitarbeit: maw)
Europäischer Gerichtshof Az.: C-219/15
Lesen Sie dazu auch den Kommentar: EuGH-Urteil: Wenig Hoffnung, wenig Trost