Auffrischungsimpfung
BioNTech / Pfizer wollen Zulassung für dritte Corona-Impfdosis beantragen
Eine dritte Impfung mit Comirnaty® soll die Antikörpertiter deutlich steigern, berichten die beiden Hersteller BioNTech und Pfizer. Sie planen daher, Anträge für die Zulassungserweiterung zur Gabe einer dritten Dosis zu stellen.
Veröffentlicht:
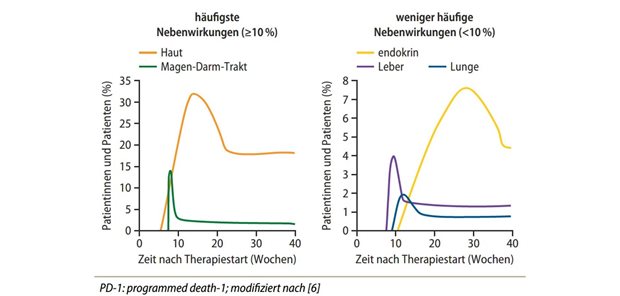
Auffrischungsimpfung nach sechs Monaten? Laut Herstellerangaben sollen die Antikörpertiter nach der dritten Impfung mit Comirnaty® 5- bis 10-fach höher sein als nach den ersten beiden Impfungen.
© Robert Michael / dpa
Neu-Isenburg. BioNTech / Pfizer planen, einen Zulassungsantrag für eine dritte Impfung mit Comirnaty® bei der US-Zulassungsbehörde FDA, der Europäischen Arzneimittelagentur EMA und anderen Zulassungsbehörden einzureichen. Hintergrund sind Angaben der beiden Hersteller zufolge Daten des israelischen Gesundheitsministeriums, nach denen die Schutzwirkung der Vakzine gegenüber Infektionen und symptomatischen Erkrankungen sechs Monate nach der zweiten Impfung abnimmt. Der Schutz gegenüber schweren Verläufen bleibe aber weiterhin hoch.
Erste Studienergebnisse wiesen darauf hin, dass eine dritte Dosis von Comirnaty® sechs Monate nach der zweiten Impfung als Auffrischung hohe neutralisierende Antikörpertiter gegen das wildtypische Virus und die Beta-Variante hervorruft und gleichzeitig ein konsistentes Verträglichkeitsprofil aufweist, so die beiden Hersteller. Die Titer seien 5- bis 10-fach höher als nach den ersten beiden Impfungen.
Ähnliche Ergebnisse erwarten BioNTech / Pfizer auch in Bezug auf die Schutzwirkung gegen die Delta-Variante. Aktuell würden dazu präklinische und klinische Untersuchungen vorgenommen. „Wir rechnen damit, dass eine dritte Dosis es möglich macht, das höchste Level an schützender Wirksamkeit gegenüber allen bisher getesteten Varianten, einschließlich der Delta-Variante, zu erhalten.“
Dennoch werde derzeit auch eine mRNA-Vakzine entwickelt, die speziell vor der Delta-Variante schützen soll. Die erste Charge der Vakzine sei bereits in BioNTechs Produktionsstätte in Mainz hergestellt worden. Die erste Studie zu dem Impfstoffkandidaten könnte bereits im August beginnen.
Die EMA sieht derzeit noch keine Datengrundlage für Auffrischungsimpfungen: „Es ist im Moment zu früh, um zu bestätigen, ob und wann eine Booster-Dosis bei COVID-Impfstoffen nötig sein wird“, teilte die Behörde auf Anfrage der Deutschen Presse-Agentur mit.