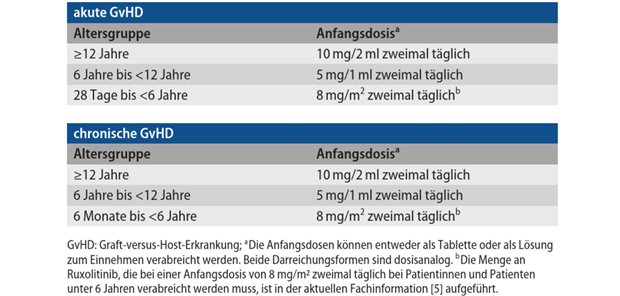
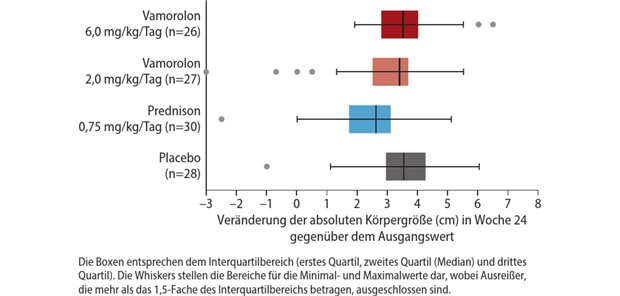
Impfung für Kinder ab sechs Monaten
BioNTech/Pfizer wollen dritte Impfdosis bei kleinen Kindern prüfen
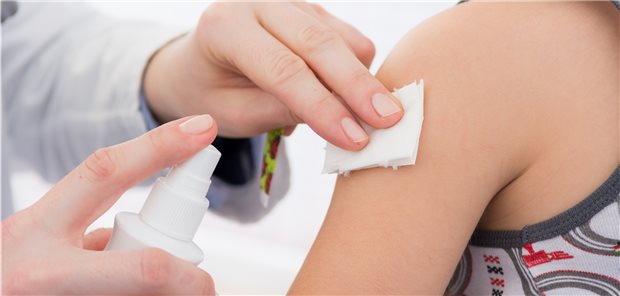
Jetzt folgt der Pieks: Wie viele Impfungen und welche Dosierung einer mRNA-Vakzine sind bei Kindern für einen optimalen Impfschutz nötig?
© Racle Fotodesign / stock.adobe.com
New York/Mainz. Pfizer und BioNTech wollen die laufenden klinischen Studien zum Corona-Impfstoff für kleinere Kinder von sechs Monaten bis vier Jahren um eine dritte Dosis ausweiten: Es soll nun eine dritte Impfstoffdosis von 3 μg untersucht werden, die frühestens zwei Monate nach Erhalt der zweiten Dosis der primären Impfserie verabreicht wird. Diese dritte Dosis soll einen hohen Schutz in dieser jungen Altersgruppe gewährleisten, teilten die Unternehmen noch vor dem Wochenende mit.
Die Entscheidung folge einer routinemäßigen Begutachtung des Studiendesigns durch das externe, unabhängige Data Monitoring Committee. Im Zusammenhang mit der laufenden und weiterhin verblindeten Studie sei in einer Subgruppe der Studienpopulation eine vordefinierte Immunogenitätsanalyse durchgeführt worden, berichten die beiden Unternehmen in einer gemeinsamen Mitteilung. Diese habe einen Monat nach Erhalt der zweiten Impfstoffdosis stattgefunden. Nach den vorliegenden Daten sprachen Kinder im Alter zwischen zwei und fünf Jahren nicht genauso gut auf die Impfung an wie Jugendliche und Erwachsene ab 16 Jahren und wie Kinder zwischen 6 und 24 Monaten. Sicherheitsbedenken seien keine festgestellt worden, so die beiden Unternehmen.
Daten sollen „in der ersten Jahreshälfte 2022“ vorliegen
Damit dürften sich die bislang noch für dieses oder Anfang nächstes Jahr erwarteten Ergebnisse verzögern. Bei erfolgreichem Verlauf der Studie mit drei Impfstoffdosen gehen Pfizer und BioNTech nun davon aus, dass sie den Aufsichtsbehörden in der ersten Jahreshälfte 2022 Daten zur Unterstützung einer Notfallzulassung für Kinder im Alter von 6 Monaten bis unter 5 Jahren vorlegen können. Die beiden Unternehmen planen laut Mitteilung zudem, die Verabreichung einer dritten Impfstoffdosis von 10 μg bei Kindern im Alter von 5 bis 12 Jahren zu untersuchen. Für Kinder ab fünf Jahren ist der Impfstoff unter anderem in den USA und in der EU inzwischen zugelassen.
Des Weiteren sei eine Teilstudie zur Untersuchung einer geringeren Dosierung initiiert worden, in der die Sicherheit und Immunogenität einer dritten Dosis von 10 μg oder 30μg bei ca. 600 Teilnehmern im Alter von 12 bis 17 Jahren untersucht werde.
Studienanpassungen mit FDA und EMA abgestimmt
Diese Studienanpassungen stützen sich auf Wirksamkeitsdaten nach drei Dosen des Impfstoffs bei Personen ab 16 Jahren sowie ersten Labordaten für die Delta-Variante und andere bedenkliche Virusvarianten, einschließlich Omikron, die darauf hindeuten, dass Personen, die mit drei Dosen eines COVID-19-Impfstoffs geimpft wurden, einen höheren Schutz haben könnten. Die genannten Änderungen seien von der US-Arzneimittelbehörde FDA und der Europäischen Arzneimittel-Agentur EMA befürwortet und mit ihnen abgestimmt worden, melden Pfizer und BioNTech.
Die Phase-I/II/III-Studie umfasst initial bis zu 4500 Kinder ab dem 6. Lebensmonat bis unter 12 Jahren in den Vereinigten Staaten, Finnland, Polen und Spanien in mehr als 90 klinischen Studienzentren. Gemäß dem Studiendesign wird die Sicherheit, Verträglichkeit und Immunogenität des Pfizer/BioNTech-Impfstoffs in einem Dosierungsschema mit zwei Dosen (im Abstand von 21 Tagen) in drei Altersgruppen untersucht: 5- bis unter 12-jährige Kinder, 2- bis unter 5-jährige Kinder und Kinder vom 6. Lebensmonat bis zum 2. Lebensjahr. Basierend auf dem Dosiseskalationsteil der Studie erhielten Kinder im Alter von 5 bis unter 12 Jahren zwei Dosen von je 10 μg, während Kinder unter 5 Jahren in der Phase-II/III-Studie eine geringere Dosis mit 3 μg pro Impfung erhielten. In die Studie wurden Kinder mit und ohne Nachweis einer vorherigen SARS-CoV-2-Infektion aufgenommen. (eb/mit Material von dpa)