Arzneimittel
„AMNOG hat Anreize für Innovationen gesetzt“
Das AMNOG hat sich nach Einschätzung aller Beteiligten bewährt. Trotz vieler Verbesserungen und verlässlicher Einsparungen besteht Reformbedarf.
Veröffentlicht: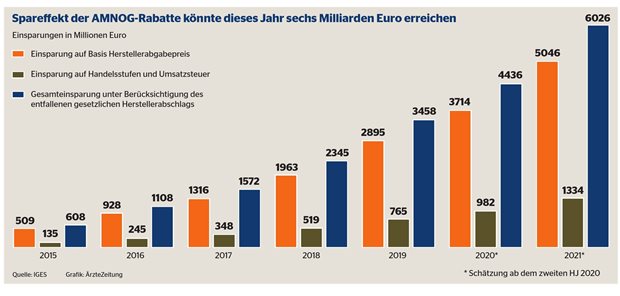
Der Spareffekt der AMNOG-Rabatte könnten 2021 sechs Milliarden Euro erreichen.
© Ärzte Zeitung
Berlin. Die vor zehn Jahren gestarteten frühen Nutzenbewertungen sind nach Einschätzung des Bundesausschusses, des Bundesgesundheitsministeriums, der forschenden Industrie und der wissenschaftlichen Fachgesellschaften ein Erfolg, auch weil sie sich als lernendes System erwiesen haben, in dem das Zusammenspiel der Beteiligten verbessert werden konnte.
474 Nutzenbewertungen habe der GBA durchgeführt, fast alle fristgerecht, so der Vorsitzende Josef Hecken. Mehr als neun Milliarden Euro Einsparungen seien dadurch erzielt worden. Die Qualität habe durch Kooperation mit den Zulassungsbehörden, frühe Beratung der Hersteller und wachsende Bedeutung des Aspekts Lebensqualität verbessert werden können. Neue Herausforderungen seien beschleunigte Zulassungen, ethische Fragen und die Durchführbarkeit von randomisierten Studien bei kleinen Zielpopulationen mit schweren Krankheiten.
Als Erfolgsfaktoren sieht Thomas Müller, Abteilungsleiter Arzneimittel im Bundesgesundheitsministerium:
- die Fokussierung der Bewertung auf wissenschaftliche Daten und deren unabhängige Bewertung durch das IQWiG insbesondere unter dem Aspekt des Patientennutzens,
- die partizipative Entscheidungsfindung unter Beteiligung der Patientenvertretung statt einer Entscheidung von Experten und
- die „dompteurhafte Sitzungsleitung“ durch den Vorsitzenden Josef Hecken, der den partizipativen Entscheidungsweg effektiv organisiert habe.
Das AMNOG habe dafür gesorgt, so Müller, dass die Industrie in relevante Forschung investiert und das Feld der Me-too-Entwicklungen verlassen habe. Dadurch seien Sprunginnovationen möglich geworden.
Reformbedarf bei Orphan Drugs
Reformbedarf erkennt Müller bei der Schärfung der Kriterien für Orphan Drugs. Bestrebungen, HTA-Verfahren auf europäischer Ebene zu harmonisieren, dürften keinesfalls zu einer Verwässerung deutscher Standards führen. Denkbar sei, Teilschritte des Verfahrens nach Europa zu verlagern. Das schwierigste und konfliktträchtigste Problem werde aber die Diskussion um Preise und Kosten angesichts einer notwendigen Sparphase zu Beginn der nächsten Legislaturperiode werden.
Neben dem Kriterium der Finanzstabilität müsse beachtet werden, dass die Industrie starke Anreize für Langzeitinvestitionen mit hohen Unsicherheiten benötige. „Pharmapreise dürfen daher nicht moralisch bewertet werden“. Für schärfere Kriterien bei der Gewährung des Orphan Drug-Status plädiert auch der Vorsitzende der Arzneimittelkommission, Professor Wolf-Dieter Ludwig. Zwischen 2013 und 2019 habe sich der Umsatz dieser Präparategruppe von 1,05 auf 3,4 Milliarden Euro mehr als verdreifacht. Inzwischen haben nach seinen Angaben einige dieser Arzneimittel Blockbuster-Umsätze erreicht.
Umsätze zu Beginn einer Forschung nicht vorhersehbar
Dem widerspricht der Präsident des Verbandes forschender Pharma-Unternehmen (vfa), Han Steutel: Nur vier Orphan Drugs erzielen in Deutschland einen Umsatz von über 100 Millionen Euro. Hinter keinem dieser Arzneimittel stehe beim Start in die Erforschung die Idee, damit gezielt vorab definierte Umsätze zu generieren. Bei Entwicklungsprozessen, die bis zu 20 Jahre dauern, sei dies generell unmöglich.
Zu bedenken sei: Wenn es kein gesellschaftliches Interesse und keine Anreize mehr gebe, in bestimmten Krankheitsgebieten zu forschen, dann werde hier auch nicht mehr investiert. Beispiele dafür seien Antibiotika und Antidiabetika.
Bei der Nutzungsbewertungspraxis fordert Steutel Verbesserungen: Anerkennung des gesamten Studienmaterials für die Bewertung, Verlässlichkeit auf Basis der Beratung durch den GBA, Abbau der Bürokratie auch hinsichtlich des Umfangs der Dossiers und die Entwicklung neuer Studienmethoden mithilfe von Künstlicher Intelligenz und Computermodellen sowie deren Anerkennung in HTA-Verfahren.