Daten und Studien Arzneimittel
AMNOG schafft eine neue Qualität für Transparenz
Mit der Implementation des AMNOG-Verfahrens hat sich in den letzten zehn Jahren die Transparenz über die Daten- und Studienlage bei Arzneimitteln deutlich verbessert – so das Resümee des IQWiG.
Veröffentlicht: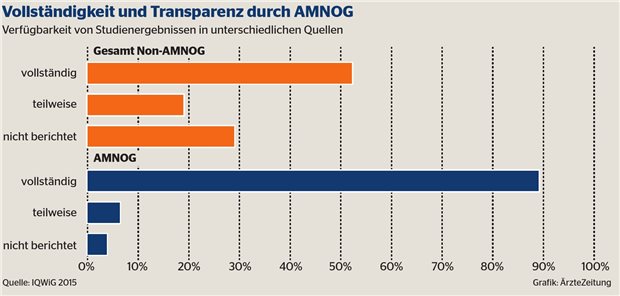
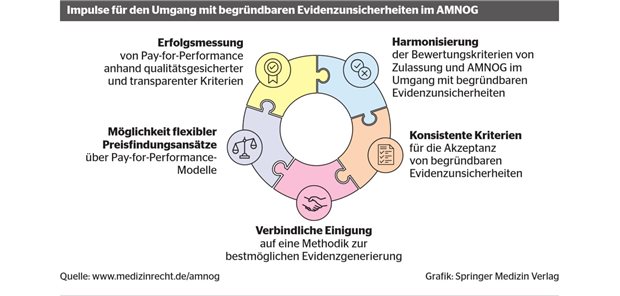
Vollständigkeit und Transparenz durch AMNOG.
© Ärzte Zeitung
Berlin. Es ist fast Fließbandarbeit geworden: Nahezu 90 Gutachtenaufträge zur Nutzenbewertung hat das Institut für Qualität und Wirtschaftlichkeit (IQWiG) im vergangenen Jahr abgearbeitet, im Startjahr des AMNOG waren es erst zwölf. Gut die Hälfte davon sind inzwischen Zweitbewertungen aufgrund befristeter Entscheidungen des Bundesausschusses oder aufgrund von Indikationserweiterungen.
Der Vorteil des gesamten Bewertungsverfahrens einschließlich der vom IQWiG erstellten Gutachten, so der Ressortleiter Arzneimittelbewertung des IQWiG, Dr. Thomas Kaiser, sei das hohe Maß an Transparenz: In fast 90 Prozent der AMNOG-Verfahren seien Studienergebnisse vollständig verfügbar, in Zulassungsberichten seien es nur knapp 30 Prozent. Im Unterschied dazu seien weite Teile der Gutachten von NICE geschwärzt. Vor dem Hintergrund europäischer Harmonisierungsbestrebungen sei hohe Achtsamkeit erforderlich, dass das erreichte Maß an Transparenz nicht gefährdet werde, so Kaiser.
Patient Reported Outcomes in den meisten Verfahren
Eine signifikante Verbesserung der Datenlage habe sich im Zeitablauf hinsichtlich patientenberichteter Endpunkte ergeben: Laut AMNOG-Report 2019 der DAK Gesundheit werden für fast drei Viertel der Verfahren auch Patient Reported Outcomes (PROs) zur Beurteilung herangezogen. Allerdings müsse die Qualität der angewandten Methoden noch deutlich verbessert werden.
Kaisers Hauptkritik richtet sich darauf, dass PRO-Studien, insbesondere in der Onkologie, sich nur auf die progressionsfreie Zeit des Überlebens erstrecken und mit Eintritt der Progression abbrechen. Dabei seien gerade PROs über die Zeit der Progression bis zum Todeseintritt besonders relevant hinsichtlich der verbliebenen Lebensqualität der Patienten.
Für Orphan Drugs, bei denen zu über 70 Prozent der Zusatznutzen nicht quantifizierbar ist, fordert Kaiser registerbasierte RCT, etwa nach dem Vorbild des schwedischen SWEDEHEART-Registers, das je Proband nur 50 Dollar Aufwand erfordert. (HL)