Medizinprodukte
Chirurgen werfen EU Blockade vor
Die von der EU angestrebte neue Medizinprodukteverordnung erhitzt nicht nur die Gemüter der Medizintechnik-Protagonisten. Die Chirurgen sehen die Innovationskraft der Branche gefährdet, da die Kooperation mit Ärzten erschwert werde.
Veröffentlicht: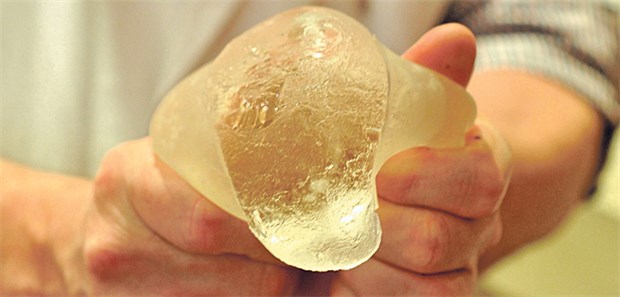
Unter anderem minderwertige Brustimplantate gaben den Anstoß für die Novellierung der EU-Medizinprodukteverordnung.
© Bruno Bebert/dpa
MÜNCHEN/BERLIN. Neue Medizinprodukte vom Herzschrittmacher bis zu Hightech-Implantaten entstehen meist durch die Kooperation von Ärzten und Herstellern. Ärzte liefern häufig die Ideen, die Industrie das notwendige technische Know-how zu deren Umsetzung.
Darauf hat die Deutsche Gesellschaft für Chirurgie (DGCH) vor Kurzem anlässlich des 132. Chirurgenkongresses in München hingewiesen und die Veranstaltung genutzt, um ihre bereits facettenreich geäußerte Kritik an den Ende September 2012 von der EU-Kommission geäußerten Vorschlägen zum Erlass einer neuen EU-Medizinprodukteverordnung (Medical Device Regulation/MDR) zu ergänzen.
Kritik an neuen Zulassungsverfahren
Die Novelle, mit der sich das EU-Parlament im Oktober 2013 in erster Lesung befasst hat, werde Innovationen blockieren, da sie die Kooperation der Medizintechnikunternehmen mit Ärzten aus Klinik und Praxis in ihrer bewährten Form beschneide, heißt es in einer gemeinsamen Stellungnahme der wissenschaftlichen Fachgesellschaft der Chirurgen und der Deutschen Gesellschaft für Biomedizinische Technik (DGBMT).
"Dieses kreative Zusammenspiel aus klinischem und technologischem Wissen ist eine wichtige Voraussetzung für medizintechnische Innovationen", mahnt Professor Ernst Klar, Direktor der Abteilung für Allgemeine, Thorax-, Gefäß- und Transplantationschirurgie an der Universitätsmedizin Rostock und Vorsitzender der Sektion Chirurgische Forschung der DGCH.
Konkret befürchtet Klar, dass die von der EU angepeilten neuen Zulassungsverfahren für Medizinprodukte kostenintensive Hürden schaffen - und damit die regulatorischen Rahmenbedingungen den Medizintechnikunternehmen nicht mehr genügend Spielraum für Innovationen lassen.
DGCH-Präsident Professor Peter M. Vogt, Direktor der Klinik für Plastische, Hand- und Wiederherstellungschirurgie an der Medizinischen Hochschule Hannover, hebt die Besonderheiten der klinischen Prüfung von Medizinprodukten hervor.
Ihre Entwicklung sei - anders als bei Arzneien - nicht nach der Einführung abgeschlossen. "Hersteller und Ärzte bemühen sich darum, die Geräte im Verlauf der Jahre immer weiter zu optimieren", erläutert Vogt. Die Reglementierung der klinischen Forschung würde unüberwindbare Hürden für die stetige Verbesserung schaffen.
Sein Kollege Klar springt ihm hier bei und warnt: "Eine Umsetzung der Entwürfe hätte eine erhebliche Erhöhung der Eingangshürden für das Inverkehrbringen von Medizinprodukten zur Folge.", so Klar.
Als weitere negative Folge erwartet er, dass durch die dann obligatorischen klinischen Studien der Zulassungsprozess für Medizinprodukte oft inakzeptabel verlängert oder gänzlich unmöglich werden könnte.
Hinzu kämen administrative Hürden, die den finanziellen Aufwand erhöhten. Klar: "Dies könnte dazu führen, dass wichtige Forschungs- und Entwicklungsvorhaben in der Medizintechnik gar nicht begonnen oder weitergeführt werden".
Klar liegt damit auf einer Linie mit Branchenverbänden. So appelliert zum Beispiel der Deutsche Industrieverband für optische, medizinische und mechatronische Technologien Spectaris an die EU, insbesondere mittelständischen Unternehmen nicht zu viele Auflagen zu machen, um sie in ihrer Innovationsfähigkeit nicht zu behindern.
Insbesondere in den Bereichen Marktzugang und bei klinischen Prüfungen seien zusätzliche innovationshemmende, bürokratische Hürden vorgesehen, die keineswegs zu der von der EU angestrebten höheren Patientensicherheit führen würden, wie sie auch von den Unternehmen befürwortet werde.
Die EU-Medizinprodukteverordnung müsse Balance halten zwischen größtmöglicher Patientensicherheit und der Stärkung der Innovationskraft, fordert Spectaris.
Ruf nach Medizinprodukteregister
Die Patientensicherheit ist auch der DGCH ein zentrales Anliegen. Ein aufwändiges Zulassungsverfahren, wie es die Medizinprodukteverordnung es vorsieht, ist nach Einschätzung des DGCH-Generalsekretärs Professor Hans-Joachim Meyer aber keine Garantie für mehr Patientensiherheit.
"Die Erfahrungen aus der Arzneimittelentwicklung zeigen, dass selbst durch große klinische Studien nicht alle Risiken erkannt werden", erläutert Meyer. Einige Nebenwirkungen würden erst nach Abschluss der Studien auftreten, andere Komplikationen seien so selten, dass sie auch bei sehr vielen Teilnehmern in Studien nicht bemerkt würden.
Um die Sicherheit zu verbessern, spricht sich der DGCH-Generalsekretär dafür aus, die Instrumente der Marktbeobachtung und -überwachung zu stärken und das gewonnene Wissen konsequent zu nutzen. "Sinnvolle Instrumente sind verbindliche Medizinprodukte- und Studienregister oder ein effizientes Meldewesen", so Meyer.
Auch unangemeldete Kontrollen bei Herstellern könnten verhindern, dass - wie beim Skandal um mit Industriesilikon gefüllte Brustimplantate des französischen Unternehmens Poly Implant Prothèse (PIP) - minderwertige Medizinprodukte verwendet werden.
Auf den PIP-Skandal rekurriert die EU-Kommission in ihrer Begründung der Vorschläge für die MDR-Novelle übrigens ausdrücklich.
Als weitere Stellschraube zur Qualitätssicherung von Medizinprodukten ist die EU mit ihrer Durchführungsverordnung vom September 2013 die benannten Stellen - ein Schwachpunkt im PIP-Skandal - angegangen und hat dafür die Zustimmung der Medizintechnikbranche erhalten.
So bewertet zum Beispiel der Bundesverband Medizintechnik (BVMed) nach eigenem Bekunden die Durchführungsverordnung positiv."Sie verbessert das Verfahren zur Benennung und Überwachung der Benannten Stellen im Medizinproduktesektor.
Wir wünschen uns, dass die Erfahrungen mit dieser Neuregelung auch in die anstehenden Verhandlungen zur europäischen Medizinprodukte-Verordnung einfließen", so BVMed-Vorstandsvorsitzender Meinrad Lugan .