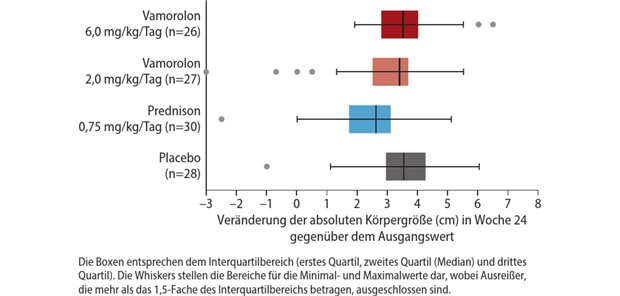
Corona-Prävention
Moderna testet Booster-Impfung gegen Südafrika-Variante
Moderna kündigt für den Herbst einen ersten Booster-Impfstoff an, der gegen die gefährliche Südafrika-Mutante des Coronavirus hilft. Zudem sind Indikationserweiterungen der Moderna-Vakzine für Kinder in Sicht.
Veröffentlicht:
Thema mit noch etlichen Variationen im Köcher: Modernas Corona-Impfstoff.
© TNS / ABACA / picture alliance
Cambridge, Mass. Das amerikanische Biotechunternehmen Moderna meldet ermutigende Daten seiner frühen klinischen Tests mit Auffrischungs- oder Ergänzungsimpfungen gegen SARS-CoV-2-Mutationen.
Aktuell werden drei Booster-Varianten geprüft: Einmal eine dritte, 50-Mikrogramm-Dosis der bereits zugelassenen Vakzine mRNA-1273. Zweiter Kandidat ist eine Modifikation („mRNA-1273.351“), die die Bauanleitung für das Spike-Protein der südafrikanische Virusmutante B.1.351 enthält, aber auch gegen die ähnliche brasilianische Variante P.1. wirken soll. Dritter Kandidat ist eine Kombination beider Wirkstoffe, die unter dem Arbeitstitel „mRNA-1273.211“ getestet wird.
Nur einer geht durchs Ziel
Wie Modernas Europachef Dan Staner im Gespräch mit der „Ärzte Zeitung“ am Mittwoch erläuterte, wird am Ende nur eine Booster-Variante, nämlich die effizienteste, zur Zulassung eingereicht. Das soll für Europa voraussichtlich bereits im September geschehen, so dass eine Zulassung noch im Oktober oder November dieses Jahres möglich wäre.
Während erste Testdaten der Kombi-Vakzine frühestens in einigen Wochen vorliegen, wurden für die beiden anderen Booster-Konzepte jetzt Phase-2-Daten auf dem Preprint-Server „bioRxiv“ veröffentlicht.
Kaum Nebenwirkungen beobachtet
Dabei kristallisiert sich zunächst der spezifisch auf die südafrikanische Mutante zugeschnittene Booster als Favorit heraus. Laut Unternehmen bewirken zwar beide Nachimpfungen eine Zunahme neutralisierender Antikörper gegen den ursprünglichen chinesischen Stamm wie auch die südafrikanische und die brasilianische Virusvariante; bei Probanden, die mRNA1273.351 erhielten, ließen sich jedoch signifikant höhere mittlere Antikörpertiter gegen B.1.351 und P.1 nachweisen.
Das Sicherheitsprofil beider Boosterkonzepte sei ähnlich, heißt es weiter, und vergleichbar dem, was zur Zweitimpfung mit mRNA-1273 in früheren Phase-2- und -3-Studien berichtet wurde. Demnach seien Nebenwirkungen meist geringfügiger oder moderater Art.
Die Quote lokaler oder systemíscher Nebenwirkungen 3. Grades habe bei der dritten Dosis des Erstimpfstoffs 15 Prozent betragen, unter mRNA-1273.3521 dagegen nur 10,5 Prozent. Schwere Nebenwirkungen 4. Grades seien nicht beobachtet worden.
Auch Kinder-Vakzine kommt voran
Fortschritte berichtet Europachef Staner unterdessen auch aus der Impfstoffentwicklung für Kinder. Eine Phase-3-Studie in den USA mit rund 3000 jugendlichen Teilnehmern vom 12. bis 17. Lebensjahr sei inzwischen abgeschlossen.
Noch im Laufe des 2. Quartals soll der Antrag auf Indikationserweiterung für mRNA-1273 in dieser Altersgruppe eingereicht werden. In der EU könnte die Marktfreigabe im Juli oder August erfolgen, ist Staner optimistisch.
Zudem arbeitet Moderna an einer Entwicklung für Kinder vom 6. Lebensmonat bis zum 11. Lebensjahr. An diesem Projekt, das seit März an Zentren in den USA und Kanada läuft, nehmen laut Staner rund 6700 Probanden teil. Erste Zulassungen sollen im Erfolgsfall bis Ende dieses Jahres beantragt werden. In der EU sei dann mit einer Freigabe im 1. Quartal 2022 zu rechnen.