BioNTech und Pfizer
Zulassung von Comirnaty® bei Kindern in Europa beantragt
Um den COVID-Impfstoff Comirnaty® auch bei 12- bis 15-Jährigen anwenden zu können, wurde jetzt die Zulassungserweiterung in Europa beantragt. In Studien war die Vakzine in diesem Alter hochwirksam.
Veröffentlicht: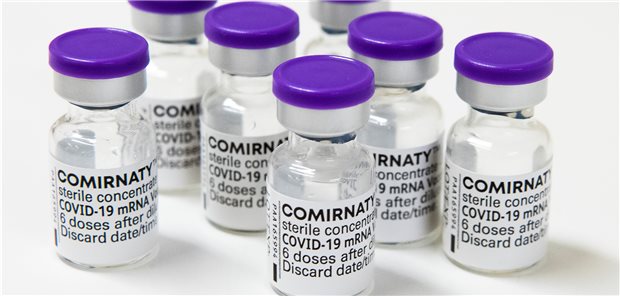
Mit Comirnaty® könnten bald erstmals auch ältere Kinder und Jugendliche unter 16 Jahren gegen COVID geimpft werden.
© Claudio Bresciani / TT / Kod 10090 / picture alliance
New York/ Mainz. Die Unternehmen Pfizer und BioNTech haben eine erweitert Zulassung für den COVID-Impfstoff Comirnaty® (BNT162b2) bei der Europäischen Arzneimittel-Agentur (EMA) beantragt. Dies soll die Anwendung der Vakzine bei Kindern und Jugendlichen im Alter von 12 bis 15 Jahren ermöglichen.
In den USA war ein entsprechender Antrag für eine Notfallzulassung („Emergency Use Authorization“) in dieser Altersgruppe bereits bei der „Food and Drug Administration“ (FDA) gestellt worden. Weiter Zulassungsanträge bei Behörden in anderen Ländern sollen in Kürze folgen. Sollte die Zulassung in Europa wie bei anderen COVID-Impfstoffen in wenigen Wochen erfolgen, könnte die Altersgruppe schon ab Juni geimpft werden.
100 Prozent Wirksamkeit bei Teenagern
Der aktuelle Antrag basiert auf einer Phase-III-Zulassungsstudie bei 12- bis 15-Jährigen, berichten die beiden Unternehmen in einer Mitteilung. Danach zeigte die Impfung sehr hohe Antikörperantworten, die sogar die robusten Werte bei geimpften 16- bis 25-Jährigen in den bisherigen Studien übertrafen. Insgesamt hatte der Impfstoff eine Wirksamkeit von 100 Prozent und war gut verträglich, so die Unternehmen.
An der Studie nahmen 2260 Jugendliche teil. Je etwa die Hälfte wurde nach dem Zufallsprinzip einer Impf- und einer Placebogruppe zugewiesen. Es wurden 18 COVID-19-Fälle in der Placebo- und kein Fall in der Impfstoffgruppe registriert. Die durch BNT162b2 bei den Impflingen induzierten und SARS-CoV-2 neutralisierenden Antikörper-Titer (geometric mean titer, „GMT“) geben die Unternehmen einen Monat nach der zweiten Dosis im Schnitt mit 1239,5 an. Bei 16- bis 25-Jährigen waren in vorherigen Srudien GMT-Werte von 705,1 registriert worden. BNT162b2 war zudem gut verträglich, das Ausmaß an Nebenwirkungen war ähnlich wie bei den 16- bis 25-Jährigen.
Darüber hinaus haben die Unternehmen mit der Vakzine ein fortlaufendes, globales Phase-I/II/III-Studienprogramm für Kinder im Alter von sechs Monaten bis elf Jahren gestartet. Darin werden Sicherheit, Verträglichkeit und Immunogenität von BNT162b2 in einem Impfplan mit zwei Dosen (etwa 21 Tage Abstand) in drei Altersgruppen geprüft (fünf bis elf Jahre, zwei bis fünf Jahre und sechs Monate bis zwei Jahre).
News per Messenger
Neu: WhatsApp-Kanal der Ärzte Zeitung
Kinderärzte: Corona-„Aufholpaket“ reicht jungen Menschen nicht
Bundes-Notbremse: Kinderärzte warnen vor erneuten Schulschließungen